Introducción
El Síndrome de DRESS comprende una reacción adversa infrecuente a fármacos, potencialmente mortal, con manifestaciones tanto cutáneas como afección orgánica o multiorgánica con una mortalidad estimada en aproximadamente 10 % de los casos1. Su incidencia exacta es desconocida, sin embargo, se estima actualmente entre 1 en 1000 y 1 en 10000 casos de exposición a fármacos siendo más común en la población adulta2.
Inicialmente se describió con el uso de antiepilépticos aromáticos, sin embargo, múltiples fármacos adicionales han sido implicados tales como la carbamazepina, sulfonamidas y el alopurinol, siendo este último responsable de hasta el 18 % de los casos3.
La patogénesis se desconoce con exactitud aunque se atribuye a una combinación entre factores genéticos que incluyen deficiencia genética de enzimas detoxificantes que llevan a la acumulación de metabolitos y respuesta inmunológica secundaria, asociaciones genéticas entre el antígeno leucocitario humano (HLA) e hipersensibilidad farmacológica específica y reacción secundaria a interacción viral y al fármaco asociado a reactivación serológica notablemente de virus de la familia de herpesviridae4. Se presenta el caso de un paciente femenino de 71 años de edad que debuta con eritrodermia a quien finalmente se realiza diagnóstico de Síndrome de DRESS por consumo de alopurinol.
Presentación del caso
Femenino de 71 años de edad, sin dermopatías conocidas solo con antecedente de hipertensión arterial sistémica en manejo con enalapril de 6 meses de evolución así como prescripción y consumo de alopurinol por médico particular debido a hiperuricemia por hallazgo incidental en laboratorios de control desde hace 5 semanas previas a su hospitalización, ingresa al servicio de medicina interna por dermatosis de 22 días de evolución caracterizada por presencia de pápulas y maculas eritematosas inicialmente en miembros pélvicos que progresa a distribución centrípeta de forma generalizada, acompañado de prurito intenso en áreas afectadas y placas descamativas. Refirió, además, mal estado general e hipertermia cuantificada de hasta 39 grados centígrados sin predominio de horario que cedía a la administración de antipiréticos. Asimismo, multitratada con 3 médicos previos, donde se indicó antihistamínicos y esteroide tópico, sin embargo, no observó mejoría y progresaron las lesiones.
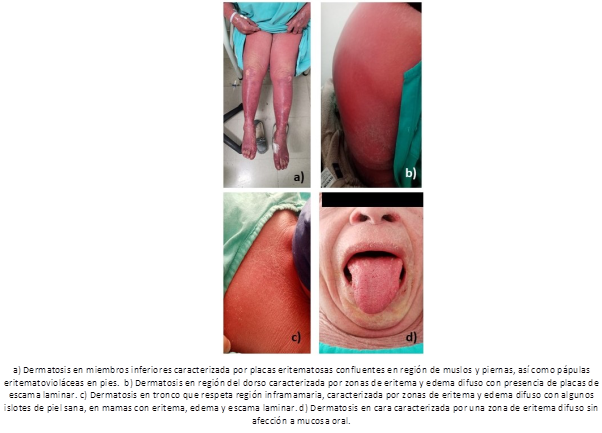
A la exploración física dirigida a piel se encuentra dermatosis diseminada a los cuatro segmentos corporales en aproximadamente más del 95 % de superficie corporal. En cabeza afecta piel cabelluda de predominio en línea de implantación frontal y frente caracterizada por una zona de eritema difuso (Figura 1), conjuntiva ocular bilateral con eritema. Extremidades superiores respeta articulaciones interfalángicas distales, caracterizada por zonas eritematoedematosas, algunas zonas eritematopurpuricas, con escama final escama laminar, afecta palmas caracterizada por placas de bordes bien definidos, configuración circular/ ovoidea constituidas por edema y eritema, algunas eritematovioláceas con zona violácea central, de aspecto en diana, algunas confluentes (Figura 1).
En tronco respeta región inframamaria, tórax postero-superior y región lumbar, caracterizada por zonas de eritema y edema difuso con algunos islotes de piel sana, en mamas con eritema, edema y escama laminar (Figura 1). En extremidades inferiores zonas constituidas por eritema, edema, pápulas eritematosas/ pápulas eritematopurpuricas y escama furfurácea, en piernas y dorso de pies caracterizada por pápulas eritematovioláceas, con tendencia a confluir (Figura 1), en plantas caracterizada por placas de bordes bien definidos, configuración circular/ ovoidea constituidas por edema y eritema pálido, zona violácea central, asentadas sobre base eritematosa, de aspecto en diana, algunas confluentes, además de pápulas purpúricas. No afección a mucosa oral ni genital. Adenopatias cervicales bilaterales discretamente dolorosas. Resto de exploración física irrelevante.
Ante la sospecha inicial de eritrodermia ampollosa ictiosiforme vs eritrodermia secundaria a farmacodermia atribuida al uso de alopurinol, se solicitaron los siguientes paraclínicos: Citometría hemática completa: Leucocitos 14.26, hemoblogina 16,6, hematocrito 49,4, paquetas 95, neutrófilos 77,13 %, linfocitos 11,92 %, eosinofilos 5,32 %, neutrófilos absolutos 11, linfocitos absolutos 1.7, eosinofilos absolutos 0,76. Se reporta en frotis de sangre periférica la presencia de linfocitos activados con abundante citoplasma y eosinofilia.
Química sanguínea: glucosa 71, urea 34,2, bun 16, creatinina 0,79, acido úrico 8. Pruebas de funcionamiento hepático: BT 2,73 BD 1,51 BI 1,22 AST 244 ALT 386 FA 112 DHL 554 GGT 222 Alb 3,4, amilasa 34, lipasa 21, LDH 648. Tiempos de coagulación: TP 18,10 prolongado, TTPA 32,4, INR 1,31. Electrolitos séricos: Ca 8,7 Na 139 Cl 106 K 4,1 P 3,1 Mg 2,1. Examen general de orina: Densidad 1,020 g/mL, Ph 5, estereasa leucocitaria negativa, nitritos negativos, proteínas 25 mg/dl, glucosa negativo, hemoglobina 25, Leucocitos 5-10 por campo, eirtrocitos 5 - 10 por campo.
Se destaca inicialmente leucocitosis con neutrofilia, trombocitopenia moderada, eosinofilia asi como presencia de linfocitos atípicos en frotis. Función renal conservada. Las pruebas de funcionamiento hepático con evidencia de transaminasemia hasta más de 3 veces valor superior normal a predominio de ALT e hiperbilirrubinemia; por análisis de factor R se documenta 10,3 puntos sugerentes de daño hepatocelular y tiempo de protrombina discretamente prolongado. Electrolitos séricos sin anormalidades. En el examen general de orina solo destaca discreta proteinuria y hematuria microscópica. Con los datos recabados al momento, se sospecha principalmente farmacodermia atribuida a uso de alopurinol con características clínicas y bioquímicas sugerentes de síndrome de DRESS, por lo que se indica suspensión inmediata de alopurinol e inicio de manejo con esteroide sistémico vía intravenoso, antihistamínicos y emolientes alternos con queratolíticos con mejoría inicial referida a expensas de disminución de prurito.
A la par de lo anterior, se continúa abordaje diagnóstico solicitando los siguientes estudios: Serologia HBV: Antigeno de superficie HBV no reactivo. Serologia HCV: Anticuerpo anti HCV no reactivo. Serologia EBV: Anticuerpo temprano IgG (EA) positivo, Anticuerpo anti EBV Cápside IgG positivo, Anticuerpo anti EBV Cápside IgM negativo, Anticuerpo anti EBV nuclear IgG positivo. ANA: Negativos. Hemocultivos periféricos para aerobios y anaerobios: Sin desarrollo. CA 125 8,29 U/ml no significativo. CA 15,3 14,91 U/ml no significativo. CA 19,9 62,56 U/ml anormal pero no significativo clínicamente. Antígeno carcinoembrionario 3,37 U/ml no significativo.
Se concluye marcadores tumorales negativos, serología para virus hepatotropicos, hemocultivos y ANA negativos, y reactivación de títulos serológicos para virus de Epstein Barr, sin reactivo para realizar análisis de virus del herpes humano tipo 6.
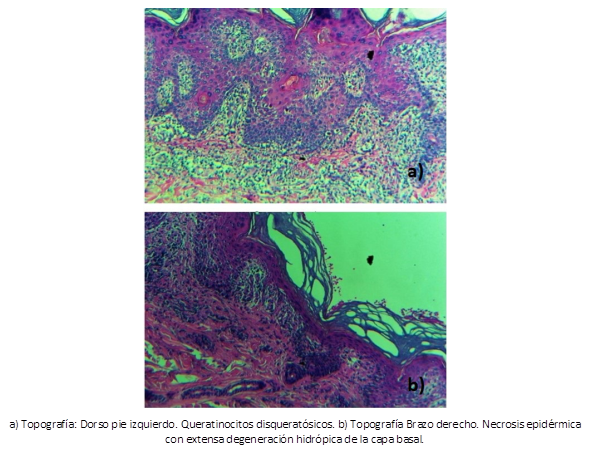
Siguiendo con protocolo dirigido a la búsqueda de la etiología se realiza mapeo de la piel con biopsia de tipo punch con muestras de muslo izquierdo, brazo derecho y dorso de pie izquierdo reportándose al análisis microscópico epidermis con capa cornea laminar, acantosis discreta, focos con necrosis de la epidermis, presencia de queratinocitos disqueratósicos, degeneración hidrópica extensa de la capa basal, en dermis superficial y media con un infiltrado linfohistiocitario denso, polvo nuclear disperso y edema importante entre las fibras de colágeno (Figura 2). Se sugirió eritema polimorfo y dermatitis de interfase como diagnóstico y hallazgo predominante respectivamente.
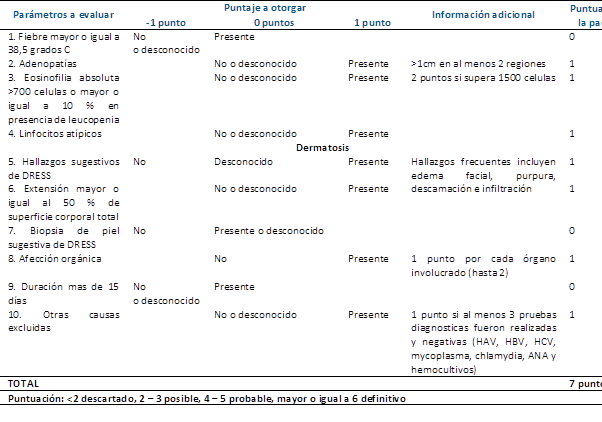
Finalmente, se realiza estudio de extensión con tomografía computada simple y contrastada toracoabdominopélvica con hallazgos de adenopatías axilares bilaterales, ganglios de aspecto inflamatorio en región inguinal y cadena iliaca externa bilateral en promedio de 15 mm (1,5 cm) y enfermedad ateroesclerosa de la aorta abdominal. Con los hallazgos reportados, se realiza puntuación según escala de RegiSCAR para DRESS obteniendo 7 puntos siendo caso definitivo (Tabla 1) (3). Ante la confirmación diagnóstica de eritrodermia secundaria a Síndrome de DRESS por consumo de alopurinol, se completan 4 días de tratamiento con esteroide sistémico con reporte de mejoría clínica y bioquímica, por lo que se decide su egreso con esteroide vía oral en esquema de dosis reducción para continuar seguimiento por consulta externa de dermatología.
Discusión
El síndrome de DRESS corresponde a una reacción de hipersensibilidad caracterizado por una combinación variable de manifestaciones clínicas y paraclínicas. En hasta el 80 % de los casos se encuentra asociación directa a un fármaco, el resto no presenta asociación clara y hasta en un 1 % no se encuentra relación alguna3.
Aproximadamente, un total de 44 fármacos han sido descritos como asociación etiológica del síndrome de DRESS, donde el alopurinol representa el segundo lugar en frecuencia con una asociación de hasta el 19 % de los casos, y de estos, un 94 % de probabilidad de obtener un puntaje según RegiSCAR de posible a definitivo5. Pese a lo anterior, en la actualidad se ha establecido que aproximadamente el 2 % de los usuarios de alopurinol presentarán reacciones de hipersensibilidad leves y solamente 0,4 % presentarán reacciones adversas cutáneas que atentan contra la vida, dentro de las cuales se encuentra el síndrome de DRESS; esto derivado a las propiedades antigénicas de su metabolito principal, el oxipurinol6. Los factores de riesgo mayormente implicados en el desarrollo de síndrome de DRESS posterior al consumo de alopurinol involucran la presencia del antígeno leucocitario humano B*58:01 así como disminución en el aclaramiento del oxipurinol por nefropatía, siendo también un parámetro pronóstico al correlacionarse con títulos altos en pacientes con persistencia de manifestaciones clínicas, y viceversa en aquellos con remisión temprana de la enfermedad6.
La sospecha clínica de síndrome de DRESS se deberá realizar en contexto de un paciente quien recibió un nuevo tratamiento en las 2-8 semanas previas y que se presenta con una erupción cutánea aguda asociada a involucro sistémico como fiebre, linfadenopatía, eosinofilia o pruebas de función orgánica alteradas7. Al interrogatorio, la paciente en el caso refirió consumo de alopurinol por hiperuricemia como hallazgo incidental en consulta del medio particular dentro del rango de tiempo reportado.
Los criterios más frecuentemente usados para confirmar o excluir el diagnóstico son los que se incluyen en el RegiSCAR, un estudio prospectivo multinacional que describió las principales manifestaciones clínicas presentadas en las reacciones adversas cutáneas severas, dentro de las cuales se incluye el síndrome de Stevens Johnson, necrólisis epidérmica tóxica, la pustulosis exantemática aguda generaliza y el síndrome de DRESS3. En base a sus resultados, se emitió una escala de evaluación específica y exclusiva para el síndrome de DRESS que se basa en las principales manifestaciones clínicas del mismo: Fiebre > 38.5°C central o > 38°C axilar, linfadenopatías en al menos dos diferentes áreas del cuerpo, eosinofilia, linfocitos atípicos, involucro de piel con rash y biopsia sugestiva de DRESS, involucro orgánico con elevación al menos dos veces de enzimas hepáticas en al menos dos días diferentes y resolución > 15 días, en donde 6 o más puntos son definitorios de la enfermedad3. En nuestro caso, se obtuvo una puntuación de 7 por lo que se confirmó el diagnóstico. La utilidad demostrada resultó de forma retrospectiva una vez concluido el abordaje diagnóstico (Tabla 1). El síndrome de DRESS siendo un proceso inflamatorio intenso, da lugar a acúmulo de metabolitos reactivos capaces de activar reacciones farmacológicas y reactivar distintos virus de la familiar Herpesviridae, lo que incluye principalmente a VHS tipo 6 y virus de Epstein Barr3. Si bien no se contaba con reactivo para el análisis de serología de VHS 6, sí se demostró reactivación serológica de títulos de Epstein Barr.
Debido a la amplia heterogeneidad de la presentación clínica, el Síndrome de DRESS puede ser mal diagnosticado por otras afectaciones cutáneas, dentro de las principales a descartar se encuentran las reacciones exantemáticas a fármacos en las cuales se puede encontrar erupciones maculopapulares con afectaciones sistémicas leves, sin embargo, el involucro visceral es ausente. Entre otras entidades a descartar, se encuentran otras farmacodermias como Síndrome de Steven Johnson /Necrólisis epidérmica tóxica, la cual compromete característicamente las mucosas, y pustulosis exantemática aguda generalizada8. Las manifestaciones clínicas de la paciente predominaron eritrodermia sin afección a mucosas y dermatitis exfoliativa por hallazgos a la exploración física.
El tratamiento indicado depende de la severidad de la presentación del síndrome de DRESS, en casos leves son solo discreta transaminasemia, se recomienda el alivio sintomático hasta la administración de antihistamínicos o esteroides tópicos. Si la presentación escala en severidad, con afección orgánica o multiorgánica, se debe iniciar administración de esteroide sistémico desde prednisona hasta metilprednisolona por un periodo de cuatro días; posteriormente, en base al a evolución clínica, se debe continuar con dosis esquema de reducción8. Nuestra paciente recibió terapia con esteroide parenteral sistémico por cuatro días y evidencia de mejoría clínica y bioquímica, por lo que acorde a guías de tratamiento, al egresar se continuo con esteroide vía oral en dosis esquema reducción y seguimiento en consulta externa de dermatología hasta la remisión de síntomas.