INTRODUCCIÓN
El virus de la hepatitis C (VHC), constituye la causa principal de las hepatitis crónicas. Si no se realiza un tratamiento adecuado, la infección crónica puede llegar a ocasionar cirrosis hepática, insuficiencia hepática y carcinoma hepatocelular (CHC). El riesgo que tienen las personas con infección crónica de adquirir cirrosis es del 15-30% dentro de los 20 años; y en personas con cirrosis el riesgo de CHC es de aproximadamente 2-4% al año1-3.
Se estima que la prevalencia global de anticuerpos frente al VHC (anti-VHC) en adultos es del 2,0 % y del 1,6 % en todas las edades, mientras que la infección virémica es del 1,4 % (1,2-1,7 %) en adultos y del 1,1 % (0,9-1,4 %) en todas las edades 4-7. En Paraguay, dos estudios (uno en comunidades indígenas y otro en población que concurrió al Instituto de Investigaciones en Ciencias de la Salud) se encontraron prevalencias de 14,9% y 6,6% respectivamente de marcadores anti-VHC 8,9.
Las principales formas de transmisión constituyen los productos hemoderivados infectados: personas que se inyectan drogas, la relacionada a asistencia sanitaria o técnicas diagnósticas invasivas, transmisión sexual, la vertical madre-hijo, la intrafamiliar que es la asociada a prácticas inadecuadas de higiene; y además tatuajes o piercing; acupuntura o circuncisión10,11.
El VHC fue identificado y caracterizado en el año 1989 mediante métodos inmunológicos y de biología molecular 12. Es un virus del género Hepacivirus de la familia Flaviviridae13,14. Su genoma es una sola molécula de ARN de aproximadamente 9.600 nucleótidos 15-17. Codifica una poliproteína la cual es procesada por proteasas virales dando lugar a 3 proteínas estructurales (core, E1, E2), la proteína p7, y 6 proteínas no estructurales (NS2, NS3, NS4A, NS4B, NS5A y NS5B) 18.
Desde el punto de vista molecular se ha clasificado 6 genotipos que difieren entre sí en un 30-33% de su secuencia, a la vez cada uno de éstos presentan variantes entre sí, que difieren en un 20-25%, y son los subtipos: genotipo 1 (subtipos a-l), genotipo 2 (subtipos a-q), genotipo 3 (subtipos a-k), genotipo 4 (subtipos a-t), genotipo 5 (subtipo a), genotipo 6 (subtipos a-q). Los genotipos 1a, 1b, 2a, 2b, 2c y 3a constituyen el 90% de todas las infecciones en América, Europa, China, antigua Unión Soviética, Japón, Australia y Nueva Zelanda, 40% de las infecciones en EEUU son causadas por los genotipos 1a y 1b. El genotipo 2a es frecuente en Japón y China, 2c en el sur de Italia. El genotipo 3 en Nepal, Bangladesh, India y Pakistán. El genotipo 4 en Egipto y África Central, el 5 en Sudáfrica, el genotipo 6 en el Sudeste Asiático 19,20.
En Latinoamérica, predomina el genotipo 1 en varios países (Argentina, Brasil, Uruguay, Chile y Colombia), seguido de genotipos 3 y 2. Los genotipos 4, 5 y 6 son muy escasos. Entre los subtipos, el más prevalente es 1b (Argentina, Brasil, Colombia) 21-24. En Paraguay, se realizó un estudio en el Instituto de Previsión Social, encontrándose en 20 muestras la presencia del genotipo 1b (40%), el 1 (15%), 1a (40%) y el 3 (5%) 25.
La prueba diagnóstica utilizada para el cribado es la serológica que permite la detección de los anti-VHC; estas pruebas presentan limitaciones como dar falsos negativos en pacientes inmunosuprimidos o hemodializados; no diferencia entre la fase aguda o crónica ni la resolución de la enfermedad en el caso de transmisión vertical; no tienen ningún valor pronóstico ni evolución de la infección además no determina la actividad replicativa viral, por todo esto se ha hecho necesario realizar técnicas de biología molecular siendo estas de gran especificidad y sensibilidad,que permiten la detección cualitativa y cuantitativa de la concentración plasmática del ARN; utilizándose la prueba de reacción en Cadena de la Polimerasa en Tiempo Real previa Transcripción Reversa (RT-PCR)4,20,26,27.
La vigilancia de la hepatitis C aguda es muy complicada, pues no se presentan síntomas en el 50-70% de los casos, por lo que no buscan atención médica, y cuando presentan síntomas, éstos son inespecíficos28,29. Anteriormente el tratamiento se basaba en la administración de interferón (IFN) y ribavirina (RBV), pero será reemplazado por nuevos fármacos denominados antivíricos de acción directa (AAD) 30, pues presentan más eficacia, son mejor tolerados, curan a la mayoría de los pacientes y su duración es más corta (normalmente 12 semanas) 31. En Paraguay se utiliza una combinación de inmunomoduladores con antivirales que son evaluadas por el hepatólogo. En la fase crónica, se ha logrado tasas elevadas de respuesta, pero estos medicamentos tienen efectos colaterales que requieren de vigilancia clínica cuidadosa 32,33.
La caracterización genotípica tiene interés clínico y epidemiológico siendo crítica para el correcto manejo terapéutico del paciente,definir la duración del tratamiento y predecir la respuesta viral, además permite conocer la distribución geográfica y las posibles formas de transmisión. Por ello se consideró oportuno determinar la frecuencia y distribución genotípica de la infección por el VHC, con el propósito de demostrar la importancia de la implementación de técnicas moleculares aplicadas a la vigilancia epidemiológica de nuestro país de manera a establecer programas de detección temprana y seguimiento adecuado de los pacientes, constituyendo unanueva herramienta altamente sensible y específica.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo, de corte transversal; se incluyeron 162 pacientes de todas las edades y de ambos sexos con infección por Hepatitis C referidos al LCSP entre febrero del 2013 y mayo del 2018, para seguimiento y/o genotipificación.
La muestra utilizada fue sangre total tomada en un tubo con EDTA, obteniéndose el plasma. Se realizó la amplificación del genoma a través de la técnica reacción en cadena de la polimerasa en tiempo real previa transcripción reversa (RT-PCR) mediante el ensayo Abbott Real Time para la determinación cuantitativa del ácido ribonucleico del virus de la hepatitis C (RNA del VHC) en plasma de pacientes infectados por el VHC. A una submuestra de pacientes con PCR detectable y carga viral >500 UI/mL se determinó el genotipo (n=52). Esta técnica tiene como región blanco la región conservada 5´UTR la cual permite identificar los genotipos 1, 2, 3, 4, 5, 6; y la región NS5b para los subtipos 1a y 1b.
El análisis estadístico se realizó mediante el Programa EPI INFO Versión 7, utilizando las siguientes variables de estudio: edad, sexo, procedencia; perfil de laboratorio: carga viral, genotipo. Para el acceso a los datos se solicitó permiso, recurriéndose a la base de datos del sistema de informático del registro de pacientes con Hepatitis C (Planilla electrónica en Microsoft Office Excel) del Departamento de Inmunología (LCSP-MSPBS). Estos datos fueron analizados acorde a la naturaleza de las variables estudiadas, para las cualitativas se recurrieron a medidas de frecuencias (porcentaje) y para las cuantitativas las medidas de tendencia central (media) y dispersión (desvío estándar).
Este estudio fue realizado de acuerdo con los principios éticos, evaluado y aprobado por el Comité de Ética del LCSP.
RESULTADOS
Durante el período de estudio han ingresado al LCSP para la determinación de carga viral y genotipificación del virus de la Hepatitis C un total de 162 pacientes, siendo atendidos 35(21,6%) pacientes en el año 2013,17 (10,5%) en el 2014, 14 (8,6%) en el 2015, 39 (24,1%) en el 2016, 44 (27,1%) en el 2017 y 13(8,0%) a mayo del 2018.
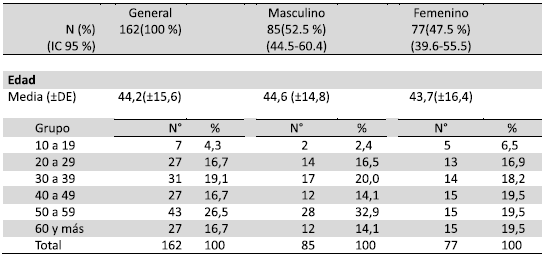
El 52,5% (85/162) correspondieron al sexo masculino. La edad media fue de 44,2 ±15,6 años, siendo el grupo de edad de 50 a 59 años con la mayor frecuencia 26,5%(43/162), seguido de 30 a 39 años con el 19,1% (31/162) (Tabla 1).
Con respecto a la procedencia de los pacientes, la mayoría provenían del departamento Central 50,7% (77/152), seguido de Asunción con un 33,6% (51/152), y en menor proporción de los departamentos de Amambay, Boquerón y Guairá con un 0,7% (1/152).
Análisis situacional de los pacientes con VHC ingresados para estudio de Carga Viral
De los pacientes ingresados en el período 2013-2016 (n=105) se constató que en el último año del presente estudio el 19,0 % (20/105) han sido analizados sus cargas virales, de los cuales el 45,0% (9/20) presentó virus circulante mayor a 12 UI/ml; 6 pacientes referidos en fase pretratamiento y 3 intratratamiento. Del grupo de pacientes sin seguimiento que corresponde al 81,0% (85/105) el 25,9% (22/85) se hallaron virus circulante mayor a 12 UI/ml, y el resto no detectable (74,1%).
Del grupo de pacientes ingresados en el último año (n=57) el 29,8 %(17/57) se hallan con carga viral detectable mayor a 12 UI/ml.
Por tanto pacientes que tienen persistencia de carga viral detectable a la fecha corresponden al 29,6% (48/162), mientras que el 38,9% (63/162) se desconoce su carga viral (Figura 1).

Figura 1: Análisis de situación de los pacientes con VHC ingresados al LCSP para estudio de carga viral y genotipificación
Con respecto a las cargas virales, éstas fueron categorizadas de la siguiente manera:
Carga viral alta: Valores mayores a 800.000 UI/ml
Carga viral baja: Valores menores a 800.000 UI/ml
No detectable
Se observa 32.09% (52/162) de pacientes con carga viral baja, 8,02% (13/162) con carga viral alta y 59,87% (97/162) de casos no detectables.
Genotipificación y variabilidad genética
De las 65 pacientes con PCR detectables solamente en 52 se realizó el análisis del genotipo viralya que los restantes tenían cargas virales bajas; observándose un predominio del genotipo 1 con 61,5 % (28,1% subtipo 1a, 53,1% subtipo 1b y 18,8% genotipo 1 sin subtipificación), el genotipo 2 con 15,4% (8/52), el genotipo 3 con 15,4% (8/52), el genotipo 4 con 7,7% (4/52) (Gráfico 1).
No se encontró correlación entre los valores de carga viral y los genotipos (p=0.1232).
DISCUSIÓN
Las hepatitis causadas por el VHC constituyen un problema de salud pública ya que son responsables del 80% de las hepatitis crónicas con posible evolución a cirrosis o carcinoma hepatocelular, consideradas como una de las posibles causas de morbilidad y mortalidad en el futuro 34.
En el presente trabajo se analizó 162 pacientes que asistieron al LCSP con prescripción médica para la determinación de carga viral y genotipificación del virus de la Hepatitis C, se encontró una mayor frecuencia de pacientes del sexo masculino (52% IC 95% 44,5-60,4%). Dicho resultado fue similar a los trabajos realizados por Araujo y col. en Brasil 15, y por Venegas y col. en Chile 13. Sin embargo Santos en Colombia, se encontraron un predominio de mujeres 35.
La edad media de los pacientes fue de 44,2 años, siendo en el sexo masculino de 44,6 años, dato que coincidecon estudios realizados por Araujo y col 15) y Santos y col 35. Con respecto a los grupos de edad, la mayor frecuencia se presentó en el de 50 a 59 años con el 26%, similar a los trabajos de Araujo y col 15 y Sulbaran y col 9 con edades mayores a 40 años; sin embargo, en el trabajo realizado por Gutiérrez y col. encontraron mayor prevalencia en la franja etaria de 40 a 49 años 21. Cabe destacar que en el presente estudio al igual que los trabajos arriba mencionados, la franja etaria con mayor frecuencia es superior a los 40 años, esto debido a que se trata de una infección latente y muchas veces silenciosa, por lo que pueden presentar alteraciones del cuadro clínico más tarde.
Con respecto a la procedencia de los pacientes, la mayoría proviene del departamento Central (50,7%) y Asunción (33,6%); esto podría deberse a la ubicación del laboratorio así como también a la fácil accesibilidad al mismo.
La determinación de la carga viral define la continuidad y la duración del tratamiento permitiendo optimizar la terapia en función de cada paciente, además, se sabe que ciertas patologías como la fibrosis hepática aumenta con cargas virales altas (superior a 800.000 UI/mL) 36. Para la determinación de la carga viral se clasificaron los valores en alta (valores superiores a 800.00UI/mL) y baja (valores inferiores a 800.000 UI/mL), obteniéndose 8,02% de pacientes con carga viral alta, 32,09% con carga viral baja y 59,87% con carga indetectable. Entre los pacientes que presentaron valores de carga viral detectables y con más de una muestra procesada, que fueron un total de 25, se encontraron que 8 obtuvieron una carga viral no detectable en su segunda muestra, sugiriendo una buena respuesta al tratamiento antivírico. No se encontró correlación entre los valores de carga viral y genotipo esto concuerda con lo descrito por Colina y col. en Uruguay 14.
La determinación genotípica del VHC posee interés clínico y epidemiológico, y en cuanto al manejo terapéutico del paciente infectado constituye en un elemento clave, es un factor pronóstico de respuesta virológica al tratamiento.
De los 162 pacientes se genotipificaron 52, encontrándose 61,5% del genotipo 1, 15,4% del genotipo 2, 15,4% del genotipo 3 y 7,7% del genotipo 4. Dentro de las muestras con genotipo 1, 17,3% correspondieron al subtipo 1a, 32,7% al subtipo 1b y 11,5% sin subtipificarse. Son muy similares a los obtenidos en un trabajo previo, llevado a cabo por Portillo y col., del Servicio de Gastroenterología del Hospital Central del Instituto de Previsión Social en el periodo de enero 2008 a setiembre 2011, el 40% fue genotipo 1b, 40% 1a, 15% 1 y 5% 3ª 17, pero con la diferencia de que no se encontraron genotipos 2 y 4.
El genotipo 1 del VHC se encuentra predominante a nivel mundial, sin embargo, el porcentaje y la distribución de subtipos difiere en cada región y país 11,12.En América Latina, se encontró predominio del genotipo 1 en países como Argentina, Brasil, Puerto Rico, Perú, México y Venezuela de acuerdo al trabajo realizado por Kershenobich y col. en donde recopilaron los datos de dichos países a través de numerosos artículos para describir la epidemiologia del VHC 37. También se encontraron predominio del genotipo 1 en Uruguay, Chile y Colombia 13-15. En cuanto a los subtipos, el 1b fue frecuente en Colombia, Chile, Brasil, Argentina y Venezuela 13,35,37, mientras que en Perú, Puerto Rico y Uruguay predominaron el 1a 14,37.
Nuestros resultados indican predominio del genotipo 1 y subtipo 1b que representa un impacto relevante ya que algunos estudios han relacionado que este genotipo y subtipo se relacionan con las transfusiones sanguíneas y la exposición parenteral en procedimientos médicos en los cuales ha habido una inadecuada reutilización y disposición de elementos contaminados, sugiriendo que estas vías podrían ser los modos de transmisión de la infección por VHC 25, pero debido que en los registros de donde se recopilaron los datos no se contemplaban los posibles factores de riesgos, no se puede afirmar con certeza las vías de transmisión de la infección.
Con respecto a los demás genotipos, se detectaron los genotipos 2 y 4 que no estaban en estudios previos en el país 17, mientras que los genotipos 5 y 6 no se encontraron, que si se han reportado en Chile 13, en el sur de África y en el sureste de Asia 38. Se destaca la presencia del genotipo 4, el cual es predominante en la región comprendida entre África Central y Oriente Medio 11,12, también fue encontrado en Argentina 5) pero al igual que en otros países del mundo, se ha visto un aumento de este genotipo relacionado con la migración de pacientes (un caso de origen egipcio de los 4 detectados en nuestro estudio) o de usuarios de drogas intravenosas o de personas infectadas por el VIH en esas regiones 13,35,39.
En cuanto a la situación de los pacientes ingresados al laboratorio, durante el período 2013-2016, acudieron 105 (64,8%) pacientes cuyas muestras fueron procesadas y solo a 20 (19%) pacientes se les realizo el seguimiento anual por parte del laboratorio, de los cuales 9(45%) presentaron valores detectables de carga viral, es decir, a este grupo reducido se ha podido realizar el monitoreo necesario. Mientras que en aquellos pacientes en los cuales no se les hizo el seguimiento anual (85 pacientes), 22 (25,9%) de ellos obtuvieron valores detectables de carga viral. La falta de seguimiento a estos pacientes podría deberse al abandono por parte de los mismos, así como también al monitoreo en otros establecimientos de salud.
En el período 2017-2018, fueron analizadas las muestras de 57 (35,1%) pacientes, de las cuales 17 (29,8%) presentaron valores detectables de carga viral, el resto fue no detectable. En países como Chile, Argentina, Colombia y México se han establecido el Plan Nacional de Control de las Hepatitis Virales, de manera a dar respuestas oportunas al diagnóstico de estas patologías desde el laboratorio y así permitir el tratamiento adecuado y eficaz de acuerdo al genotipo identificado, evitando así que las complicaciones hepáticas se desarrollen 40-43. En Paraguay, existe un Sistema Nacional de Vigilancia Epidemiológica pero surge la necesidad de contar con un programa de Vigilancia y Control del VHC, para así poder trabajar de manera conjunta con el Programa Nacional de Lucha contra el Sida y los bancos de sangre y obtener datos relevantes y reales sobre la epidemiologia de esta patología en todo el territorio nacional.
El presente estudio podría proporcionar información de un valor importante en cuanto a definir la estrategia terapéutica más adecuada, lo que es de gran relevancia en materia de política sanitaria si se considera el comportamiento de los distintos genotipos frente al tratamiento antiviral, ya que se sabe que los genotipos 1 y 4 responden un 40% menos que los genotipos 2 y 3 al tratamiento estándar de INFpeg+RBV. Además es también útil para la elección de la duración del tratamiento, ya que los tratamientos son caros y los regímenes de tratamiento más cortos suponen un ahorro considerable de gastos.
CONCLUSIONES
Este estudio refleja una mayor incidencia de la infección por el virus de la hepatitis C en pacientes de sexo masculino; una mayor frecuencia del genotipo 1 (subtipo 1b), en el cual el grupo de edad que presento el mayor número de casos es de 50 a 59 años; además se encontraron pacientes con genotipo 4. Los grandes avances en el tratamiento del virus de la hepatitis C deben complementarse con la detección masiva de los pacientes y su tratamiento, de manera a reducir el impacto en la salud pública. Por tanto, se demuestra la importancia de la implementación de técnicas moleculares aplicadas a la vigilancia epidemiológica de nuestro país de manera a establecer programas de detección temprana y seguimiento adecuado de los pacientes, ya que la caracterización genotípica ayuda a determinar las estrategias terapéuticas más adecuadas, predecir la respuesta antiviral y la duración óptima del tratamiento.