Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista del Nacional (Itauguá)
Print version ISSN 2072-8174
Rev. Nac. (Itauguá) vol.5 no.2 Itauguá Dec. 2013
CASO CLÍNICO
Hepatitis aguda fulminante por dengue complicada con pioderma gangrenoso
Acute fulminant dengue hepatitis complicated with pyoderma gangrenosum
Daiana Correa1, Raúl Real1, Valeria Fridman2, Libia Martínez2, Arnaldo Aldama2, Gloria Mendoza3, Víctor Cabanellas4, Laura Céspedes4.
RESUMEN
Se presenta el caso de una mujer de 53 años que ingresó por dengue con afectación hepática severa. Durante su internación desarrolla un pioderma gangrenoso que requirió tratamiento con corticoides.
Palabras claves: dengue, hepatitis aguda, hepatitis fulminante, pioderma gangrenoso
ABSTRACT
We present a case of a 53 year-old woman who was admitted with dengue and severe hepatic failure. During hospitalization she developed pyoderma gangrenosum that required corticosteroid treatment.
Keywords: dengue, acute hepatitis, fulminant hepatitis, pyoderma gangrenosum
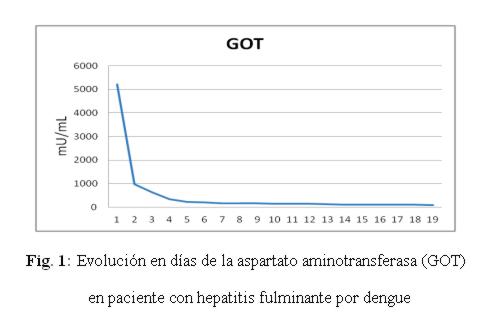
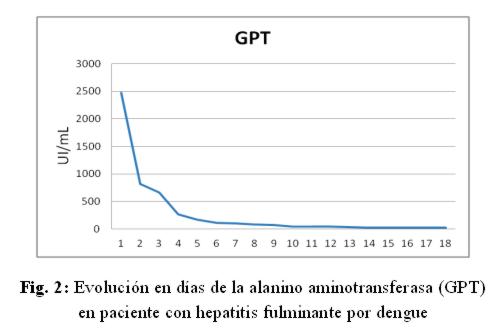
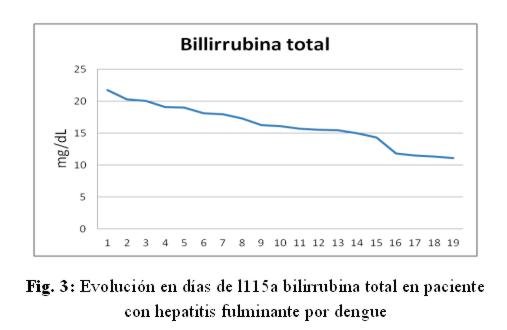
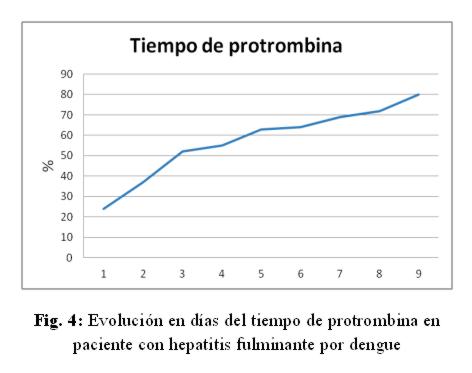
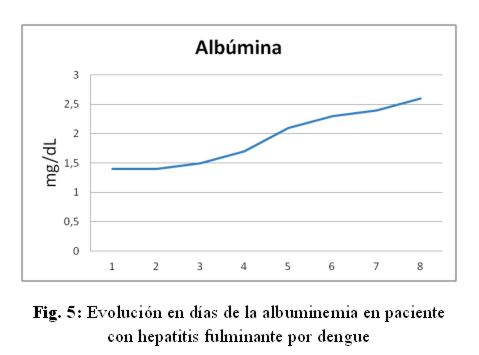
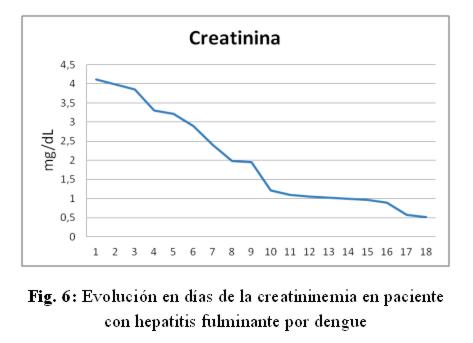
Caso clínico: paciente de sexo femenino, 53 años de edad, ama de casa, acudió al hospital de su comunidad por cuadro de cinco días de sensación febril no graduada, sudoración profusa, cefalea holocraneana, mialgias y artralgias generalizadas. Fue tratada ambulatoriamente con paracetamol 1g cada 6 hs VO, mejorando. Posteriormente presentó náuseas y vómitos en dos oportunidades de contenido alimentario, quedando internada. No refirió antecedentes patológicos de interés, negó etilismo y cuadros ictéricos previos. El laboratorio de ingreso fue: NS1 para dengue positivo, plaquetas menor a 10.000/mm3, hemoglobina 13,5 g/dL, hematocrito 47%, GOT 9553 UI/L, GPT 4616 UI/L, fosfatasa alcalina 484 U/L, bilirrubina total 6,48 mg/dl, bilirrubina directa 4,93 mg/dL, tiempo protrombina 20%, TTPA 35 segundos, PCR 48 mg/dL. Durante esa internación presentó excitación psicomotriz por lo que fue remitida al Servicio de Terapia Intensiva del Hospital Nacional. Al llegar al Servicio, ingresó confusa, ictérica, deshidratada, afebril, taquipneica e hipertensa. Se constató abdomen globuloso, blando, depresible, doloroso a la palpación en hipocondrio derecho, hígado a 3 cm del reborde costal derecho, ruidos hidroaéreos presentes. El sistema nervioso con escala Glasgow 13, sin focalización motora, flapping ni signos meníngeos. Los hallazgos laboratoriales fueron similares a los iniciales pero con tendencia al empeoramiento del hepatograma. Se confirmó dengue por anticuerpo IgM positivo. Los valores extremos de laboratorio observados en los días siguientes fueron: bilirrubina total 21,72 mg/dL, bilirrubina directa 15,2 mg/dL, GOT 5219 UI/mL, GPT 2476 UI/mL, tiempo de protrombina 24%, albúmina 1,4 mg/dL, urea 142 mg/dL, creatinina 4,11 mg/dL. (fig 1-6) Se realizó ecografía abdominal que informó hepatomegalia (180 mm), pared vesicular engrosada con litiasis en su interior, vías biliares no dilatadas, líquido libre en cavidad (340 cc en fondo de saco de Douglas) e interasas intestinales, espacios pleurales libres. Tomografía axial computada de cráneo normal.
Se plantearon los diagnósticos: insuficiencia hepática, encefalopatía hepática, hepatotoxicidad por paracetamol vs hepatitis aguda por dengue, dengue con signos de alarma, obesidad. Presentó evolución tórpida, con persistencia de ictericia, bilirrubina en ascenso, crasis alterada y alteración del estado de conciencia a pesar de la reanimación con fluidos por lo que se diagnosticó hepatitis fulminante.
Ante la dificultad respiratoria fue intubada y conectada a asistencia respiratoria mecánica, tuvo hemodinamia inestable con requerimiento de inotrópicos, se agregó una infección urinaria y posteriormente una infección respiratoria nosocomial por Klebsiella pneumoniae y Acinetobacter baumannii que se trataron con antibióticos.
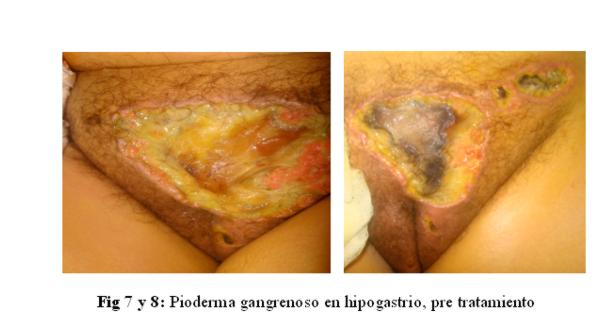
A la semana apareció una lesión ulcerativa de 10 por 8 cm en piel de hipogastrio y genital, de fondo necrótico, y área amarillenta, fibrinosa, de bordes sobreelevados, eritematovioláceos, irregulares, limites netos, de crecimiento progresivo (figuras 7 y 8).
Tras 15 días de estabilización de la hemodinamia, control de las infecciones y función respiratoria se la extuba con éxito, fue trasladada a sala de Clínica Médica. Allí ingresó con ictericia persistente, fuerza muscular disminuida globalmente, perfil renal alterado, con nuevas ulceraciones en región vulvar. Se sospechó pioderma gangrenoso e inició corticoides (prednisona 1 mg/kg/día), con mejoría gradual. Los cultivos de heridas retornaron negativos y la biopsia confirmó posteriormente la sospecha clínica.
El proteinograma electroforético fue normal, las serologías para virus de la hepatitis y HIV fueron todas negativas, así como ANA, anti DNA, anti músculo liso, antimicrosomal y ANCA-p. El ANCA-c fue positivo: 22 U/mL (valor normal <15 U/mL).
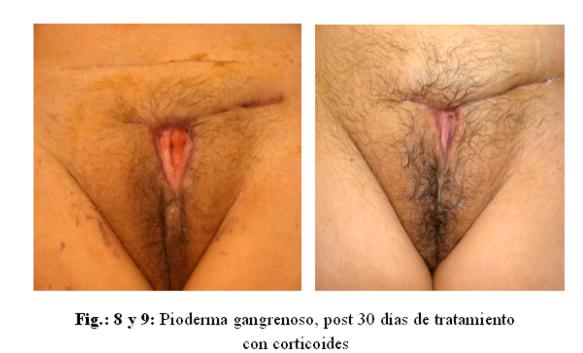
La paciente fue tratada de acuerdo al protocolo de dengue del Ministerio de Salud del Paraguay,1 además recibió lactulosa, soporte nutricional, concentrado de L-ornitina más L-aspartato, corticoides a dosis citada, con mejoría gradual del cuadro en piel (figuras 9 y 10).
Luego de tres meses del alta fue sometida a colonoscopía, sin hallazgos de valor y descartándose enfermedad inflamatoria intestinal. Para ese momento su hepatograma y función renal se normalizaron.
DISCUSIÓN
Este caso de dengue se caracterizó por una severa afectación renal y hepática, al punto de llegar a generar encefalopatía, lo que se conoce como hepatitis fulminante2. No se duda del dengue como agente causal de la insuficiencia hepática ya que la paciente ingirió las dosis terapéuticas recomendadas de paracetamol y fueron descartados agentes virales habituales y mecanismos patogénicos autoinmunes. El paracetamol es reconocido como fármaco hepatotóxico pero este efecto se relaciona a dosis elevadas y en sujetos susceptibles como en los alcohólicos. Las dosis terapéuticas no deben exceder 4 g/día en adultos, que corresponde a la mitad ingerida por esta paciente3.
El aumento de las animotransferasas es un fenómeno común en el dengue, a veces a niveles muy elevados, pero con la característica de ser transitoria y reversible4. El aumento de estas enzimas por más de 10 veces el valor normal se observa en casi 20% de sujetos con dengue5. Estas alteraciones pueden observarse incluso una vez terminado el periodo activo de la enfermedad6. Las descripciones de insuficiencia hepática aguda o hepatitis fulminante por dengue son escasas. La sobrevida a la hepatitis fulminante de cualquier etiología es sólo 40%6. No obstante, en una serie de 55 sujetos con dengue y hepatitis fulminante la sobrevida fue 100%8.
En animales de experimentación se ha observado que el virus del dengue produce esteatosis hepática, edema y necrosis del hepatocito, destrucción de las células de Kupffer, además de eritrofagocitosis, edema intersticial, daño de pared vascular y hemorragia intraparenquimatosa9-11. Este daño produce característicamente un aumento superior de la GOT en comparación a la GPT como lo observado en esta paciente, al contrario de la lesión por los virus de la hepatitis B y C en que aumenta más la GPT12-15.
En relación al uso de de L-ornitina más L-aspartato existe una revisión extensa con meta análisis demostrando su efectividad en el tratamiento de la encefalopatía hepática, comparado con placebo16.
La aparición de una afección inmune en piel de esta paciente, el pioderma gangrenoso, es una concomitancia que podría asociarse al dengue ya que hay descripciones de enfermedades inmunológicas que despiertan o se exacerban con la gran liberación de citoquinas que se produce en el dengue17,18. Si bien la etiología de esta afección dermatológica es desconocida, existe una alta asociación con la enfermedad inflamatoria intestinal, que fue descartada en esta paciente19,20. En la etiopatogenia del pioderma gangrenoso se cree que existe una disregulación del sistema inmune, específicamente una alteración en la quimiotaxis de los neutrófilos21,22. No se encontró en una revisión de la literatura científica en Medline una asociación con el dengue. No obstante, hay diversos reportes de enfermedades autoinmunes como el Lupus eritematoso sistémico que se desencadenan por el dengue18.
El propósito de este reporte fue alertar a los médicos que ante todo paciente con insuficiencia hepática aguda en una zona endémica de dengue debe considerarse a esta infección como causante de la misma5.
REFERENCIAS
1. Paraguay. Ministerio de Salud Pública y Bienestar Social. Dengue. Guía de Manejo Clínico 2012. Disponible en http://www.mspbs.gov.py [ Links ]
2. Jayakumar S, Chowdhury R, Ye C, Karvellas CJ. Fulminant viral hepatitis. Crit Care Clin. 2013 Jul; 29(3):677-97. [ Links ]
3. Chun LJ, Tong MJ, Busuttil RW, Hiatt JR. Acetaminophen hepatotoxicity and acute liver failure. J Clin Gastroenterol. 2009 Apr; 43(4):342-9. [ Links ]
4. Valero CN, Reyes VI, Larreal EY, Maldonado EM. Aminotransferases serum levels in patients with Dengue type 3. Rev Med Chil. 2007 Oct;135(10):1304-12. [ Links ]
5. Jagadishkumar K, Jain P, Manjunath VG, Umesh L. Hepatic involvement in dengue Fever in children. Iran J Pediatr. 2012 Jun;22(2):231-6. [ Links ]
6. Trung DT, Thao le TT, Hien TT, Hung NT, Vinh NN, Hien PT et al. Liver involvement associated with dengue infection in adults in Vietnam. Am J Trop Med Hyg. 2010 Oct;83(4):774-80. [ Links ]
7. Lidofsky SD. Liver transplantation for fulminant hepatic failure. Gastroenterol Clin North Am. 1993;22(2):257. [ Links ]
8. Tan SS, Bujang MA. The clinical features and outcomes of acute liver failure associated with dengue infection in adults: a case series. Braz J Infect Dis. 2013 Mar-Apr;17(2):164-9. [ Links ]
9. Paes MV, Lenzi HL, Nogueira AC, Nuovo GJ, Pinhão AT, Mota EM et al. Hepatic damage associated with dengue-2 virus replication in liver cells of BALB/c mice. Lab Invest. 2009 Oct;89(10):1140-51. [ Links ]
10. Barth OM, Barreto DF, Paes MV, Takiya CM, Pinhão AT, Schatzmayr HG. Morphological studies in a model for dengue-2 virus infection in mice. Mem Inst Oswaldo Cruz. 2006 Dec;101(8):905-15. [ Links ]
11. Sung JM, Lee CK, Wu-Hsieh BA. Intrahepatic infiltrating NK and CD8 T cells cause liver cell death in different phases of dengue virus infection. PLoS One. 2012;7(9):e46292. [ Links ]
12. Larreal Espina YL, Andrade Zambrano EL, Cuevas Ruiz YE, Mendoza Rico AS, Montiel Aguilar MV, Levy Guiffrida AC et al. Liver function tests in patients with acute viral infection. Acta Bioquím Clín Latinoam 2012; 46(1): 39-46 [ Links ]
13. Agarwal MP, Giri S, Sharma V, Roy U, Gharsangi K. Dengue causing fulminant hepatitis in a hepatitis B virus carrier. Biosci Trends. 2011;5(1):44-5. [ Links ]
14. Oliveira GS, Nicodemo AC, Carvalho VC, Zambrini H, Siqueira AM, Amato VS, Mendes-Correa MC. Severe hepatitis and jaundice during the evolution of dengue virus infection: case report. Rev Soc Bras Med Trop. 2010 May-Jun;43(3):339-41. [ Links ]
15. Ling LM, Wilder-Smith A, Leo YS. Fulminant hepatitis in dengue haemorrhagic fever. J Clin Virol. 2007 Mar;38(3):265-8. [ Links ]
16. Bai M, Yang Z, Qi X, Fan D, Han G. l-ornithine-l-aspartate for hepatic encephalopathy in patients with cirrhosis: a meta-analysis of randomized controlled trials. J Gastroenterol Hepatol. 2013 May;28(5):783-92. [ Links ]
17. Jardim DL, Tsukumo DM, Angerami RN, Carvalho Filho MA, Saad MJ. Autoimmune features caused by dengue fever: a case report. Braz J Infect Dis. 2012 Jan-Feb;16(1):92-5. [ Links ]
18. Wiwanitkit V. Autoimmune and dengue fever. Braz J Infect Dis. 2012 Sep-Oct;16(5):495. [ Links ]
19. Aldama A, Rivelli V. Dermatología. 1ª ed. Asunción: EFACIM, 2009 [ Links ]
20. Ahronowitz I, Harp J, Shinkai K. Etiology and management of pyoderma gangrenosum: a comprehensive review. Am J Clin Dermatol. 2012 Jun 1;13(3):191-211. [ Links ]
21. Brooklyn T, Dunnill G, Probert C. Diagnosis and treatment of pyoderma gangrenosum. BMJ. 2006 Jul 22;333(7560):181-4. [ Links ]
22. Weenig RH, Davis MD, Dahl PR, Su WP. Skin ulcers misdiagnosed as pyoderma gangrenosum. N Engl J Med. 2002 Oct 31; 347(18):1412-8. [ Links ]
1. Departamento Medicina Interna, Hospital Nacional. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
2. Servicio de Dermatología. Departamento de Medicina Interna, Hospital Nacional. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
3. Anatomopatóloga. Instituto de Anatomía Patológica. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
4. Servicio de Terapia Intensiva de Adultos. Departamento de Medicina Interna, Hospital Nacional. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
Artículo recibido: 21 de octubre de 201. Artículo aprobado: 27 de noviembre de 2013
Correo Electrónico: daianacorrea585@gmail.com