INTRODUCCIÓN
Staphylococcus aureus (SA) es un coco gram positivo, de distribución universal. Posee factores de virulencia que determinan su persistencia, recurrencia y tendencia a causar infecciones secundarias.
Las infecciones por SA adquirido en la comunidad (SA-CA) se presentan en pacientes con o sin enfermedades subyacentes y generalmente se acompañan de infecciones de piel y partes blandas la mayor parte de las veces.
Puede causar una amplia gama de enfermedades, tales como artritis, osteoartritis, septicemia, endocarditis, neumonías, meningitis, además de lesión de piel y partes blandas. En muchos casos el paciente puede requerir cuidados intensivos o internaciones prolongadas. En casos graves, puede ocasionar la muerte1.
La aparición del Staphylococcus aureus como agente etiológico de diversas patologías infecciosas se ha hecho más frecuente como resultado del uso de las vacunas contra el neumococo y meningococo2.
Es un patógeno comensal que puede colonizar la piel y membranas mucosas de humanos. El incremento de la resistencia del SA a la meticilina (SAMR) lo ha puesto en el foco de la preocupación, pues la presencia de resistencia se asocia con evoluciones más graves e incluso letales3.
Los mecanismos de resistencia son causados por alteración de los componentes del genoma de esta bacteria4.
A medida que pasan los años, es más frecuente la aparición de cepas de Staphylococcus aureus resistente a la meticilina (SAMR)5-6
En Paraguay contamos con reportes de estudios de sensibilidad de los SA-CA con cifras de resistencia a la meticilina que van de 40 a 72%7-10)
Las infecciones invasoras por SARM, así como las cepas con sensibilidad intermedia a Vancomicina (conocidas como VISA) se asocian con mayor mortalidad y coste económico que las causadas por SAMS. Por todo ello, la vigilancia y el control de SARM debe ser una prioridad para todos los centros hospitalarios11,12
Se debe destacar que los patrones de resistencia de este germen pueden variar entre regiones, países e inclusive entre centros hospitalarios de un mismo país. De allí la importancia de realizar un constante monitoreo de la sensibilidad y resistencia del mismo que permita un abordaje terapéutico adecuado13.
OBJETIVO
Determinar el perfil de Resistencia del SA-CA a los diversos antibióticos, en una población pediátrica, en un lapso de 6 años.
METODOS
Estudio de prevalencias, retrospectivo, con componente analítico, de casos consecutivos. Se recolectaron todas las muestras de los pacientes con edades comprendidas de 1 mes a 15 años, internados en el Departamento de Pediatría del Hospital Nacional con cultivo positivo a SA-CA entre enero de 2015 y diciembre 2020.
La muestra, obtenida al ingreso hospitalario, procedió de sitios estériles y/o de colecciones purulentas. Se excluyeron muestras de pacientes con más de 72 horas de internación.
El test de sensibilidad a antimicrobianos se efectuó en equipo automatizado BacT/Alert® que tiene incorporados los puntos de corte para interpretación de las categorías: sensible, Intermedio o Resistente, del CLSI (Clinical and Laboratory Standards Institute, USA).
Para determinar la resistencia a Meticilina se utilizó oxacilina por ser un antibiótico químicamente más estable que la meticilina.
Para el análisis se utilizó paquete estadístico de Excel de Microsoft Estándar 2016.
RESULTADOS
Fueron ingresados al estudio 244 cepas. Un total de 99 (59%) provinieron de sujetos del sexo masculino.
La distribución por edad no demostró que exista en esta investigación diferencias entre las prevalencias de resistencia por grupo etario (Tabla 1)
Tabla 1. Comparación de grupos etarios de la población con aislados positivos a SAMR de la comunidad y SAMS, 2015-2020. N= 168.
| Grupo Etario Número de pacientes | Casos Totales N: 168 | SAMR n: 121 | SAMS n: 47 | P* < 0,05 |
|---|---|---|---|---|
| menores de 1 año | 42 (25%) | 26 (21,5%) | 15 (32%) | NS |
| 2 a 5 años | 34 (20%) | 26 (21,5%) | 9 (19%) | NS |
| 6 a 11 años | 50 (30%) | 36 (30%) | 14 (30%) | NS |
| 12 a 15 años | 42 (25%) | 33 (27%) | 9 (19%) | NS |
*Chi cuadrada
El aislamiento del germen fue principalmente de piel y partes blandas (PPB) seguido por el aislamiento en sangre, independientemente de su perfil de resistencia. (Tabla 2).
Tabla 2. Distribución de los sitios de aislamiento de S. aureus de la comunidad, 2015-2020. N= 244.
| AISLAMIENTO | SAMR | % | SAMS | % |
|---|---|---|---|---|
| Sangre | 64 | 37,4 | 30 | 41 |
| Piel y Partes Blandas | 91 | 53,2 | 30 | 41 |
| Liquido Articular | 3 | 1,7 | 9 | 12,4 |
| Liquido Pleural | 1 | 0,6 | 1 | 1,4 |
| Líquido Cefalorraquídeo | 4 | 2,4 | 1 | 1,4 |
| Orina | 6 | 3,5 | 1 | 1,4 |
| Abscesos profundos | 2 | 1,2 | 1 | 1,4 |
| TOTAL | 171 | 100 | 73 | 100 |
Del total de aislados de Staphylococcus aureus, obtuvimos un 72% de cepas resistentes a la meticilina (SAMR) (121/168) y 28% de cepas sensibles a dicho antibiótico (SAMS) (47/168).
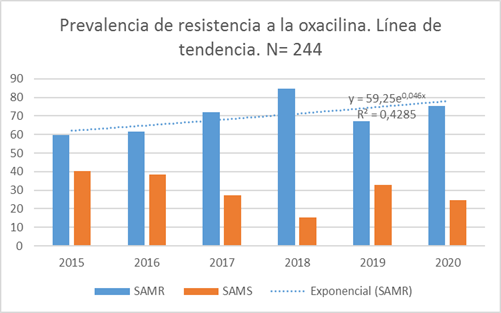
Las prevalencias de las resistencias a la meticilina, durante los años estudiados puede observarse en la Tabla 3.
Tabla 3: Distribución de la resistencia y sensibilidad por año de los aislados positivos a S. aureus de la comunidad, 2015 - 2020. N= 244
| AÑO | n | SAMR | SAMS | ||
|---|---|---|---|---|---|
| n | % | N | % | ||
| 2015 | 52 | 31 | 59,6 | 21 | 40,4 |
| 2016 | 26 | 16 | 61,5 | 10 | 38,5 |
| 2017 | 36 | 26 | 72,2 | 10 | 27,3 |
| 2018 | 39 | 33 | 84,6 | 6 | 15,4 |
| 2019 | 46 | 31 | 67,3 | 15 | 32,7 |
| 2020 | 45 | 34 | 75,5 | 11 | 24,5 |
| TOTAL | 244 | 171 | 100 | 73 | 100 |
Se analizó la tendencia de las resistencias y sensibilidades a la meticilina, encontrando una tendencia al aumento de los SAMR, mientras que los SAMS tienden a decrecer. (Figura 1)
En ninguna cepa la CIM sobrepasó el valor de 1 µg/ml.
Otro aspecto analizado fue la resistencia de las cepas de SAMR-CA a otros antibióticos, lo cual puede observarse en la Tabla 4.
Tabla 4: Descripción de resistencia a diferentes antibióticos de los SAMR de la comunidad. 2015-2020 (n=173)
| cepas Samr/año | 2015 - 31 | 2016 - 16 | 2017 - 26 | 2018 - 33 | 2019 - 31 | 2020 - 34 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Clindamicina | 9 | 29 | 2 | 11,1 | 0 | 4 | 12,5 | 3 | 8,7 | 5 | 16 | |
| Eritromicina | 9 | 29 | 2 | 11,1 | 0 | 4 | 12,5 | 3 | 8,7 | 5 | 16 | |
| Tetraciclina | 0 | 0 | 0 | 0 | 1 | 4,3 | 0 | |||||
| Rifampicina | 0 | 0 | 2 | 7,6 | 1 | 4,1 | 1 | 4,3 | 0 | |||
| Ciprofloxacina | 0 | 0 | 2 | 7,6 | 1 | 4,1 | 1 | 4,3 | 0 | |||
| Tmp-smz | 0 | 0 | 0 | 0 | 0 | |||||||
| Gentamicina | 3 | 8,7 | 0 | 2 | 7,6 | 0 | 3 | 8,7 | 4 | 12 | ||
Se encontró una sensibilidad alta a TMP/SMZ, quinolonas, clindamicina y Tetraciclinas. Resistencia inducible a clindamicina de 12,5 %.
DISCUSION
Staphylococcus aureus, como agente causal de enfermedades graves se presenta con frecuencia creciente a través de los años en pacientes en edad pediátrica, ocasionando preocupación en la comunidad médica en el momento de elegir la mejor opción de tratamiento para los pacientes, debido a la resistencia creciente a la meticilina
La prevalencia de resistencia del SA-CA a la meticilina varía entre países y continentes, con prevalencias que van de 13 a 74%, con resistencias mayores en los países del sur de Europa, con respecto a los del sur de Europa14.
En la región del Conosur contamos con diversas informaciones que hacen énfasis en los porcentajes de Resistencia de SAMR-CA, desde cifras de 85% reportado por Casellas en 2011, 52% en Cuba en el 2017, 33% en Venezuela en 2002, 43% en Colombia en 2018, una meticilino resistencia de 18% en Chile en el año 2016, 55% en reportes de EEUU, hasta un 79% en Argentina en el año 201815-21.
Todos los autores antecitados expresan preocupación por el incremento de resistencia y el escaso arsenal terapéutico para enfrentar esta situación.
En nuestro país los reportes de la resistencia han sido disimiles, fluctuando entre 40% a 72% en el último reporte de 2015.
El conocer los índices de resistencia del SA a los diferentes antibióticos es de fundamental importancia a la hora de decidir la terapia empírica, sobre todo en los casos que se presentan con formas clínicas graves ya que sabemos que el retraso en terapia antibiótica apropiada puede llevar a aumento de la mortalidad y morbilidad en estos pacientes22.
La alta prevalencia de SAMR-CA encontrados en nuestra casuística supone el desafío de iniciar antibióticos empíricos para cobertura adecuada de los gérmenes involucrados, teniendo en cuenta a pacientes con infecciones por SAMR-CA sin descuidar la posible presencia de SAMS-CA.
Esta tendencia creciente en la resistencia del SAMR-CA presupone un riesgo para el manejo terapéutico de los pacientes, pues la gama de antibióticos disponibles para tratar esta bacteria irá disminuyendo.
Si bien algunos autores mencionan comorbilidades subyacentes como un factor asociado a estas infecciones, nosotros no pudimos replicar ese resultado23.
Se ha propuesto que los SAMR-CA podrían tener peor evolución según su concentración mínima inhibitoria (CIM), ya que a mayor CIM de meticilina, más probabilidades de fracaso terapéutico. Es importante hacer notar que el médico tratante debe estar pendiente de estos valores a fin de plantear tempranamente intervenciones terapéuticas en caso de aparición de los llamados estafilococos con sensibilidad disminuida a la vancomicina, cuyo MIC es de 8 mg/l y que presentan patrones de heterorresistencia, asociados a uso prolongado de glicopéptidos. Son conocidos también como SA de tipo VISA (SA con sensibilidad intermedia a vancomicina) o GISA (SA con sensibilidad intermedia a glicopéptidos)15,24
Afortunadamente en este trabajo no encontramos este tipo de cepas y las MIC se mantuvieron con valores de 0,5 a 1 µg/ml
Las tendencias actuales de las resistencias nos impulsan a proponer como tratamiento empírico en infecciones en que se sospeche SA de la comunidad, cobertura para SA meticilino sensible y meticilino resistente. En pacientes estables, el IDSA sugiere iniciar cobertura con clindamicina. Por otro lado, en pacientes sépticos e inestables, se sugiere el uso de glicopéptidos25.
Hay que recordar que los SARM -CA de la comunidad presentan una velocidad de duplicación inusual (cada 20 minutos), que determina que las infecciones que provocan ocurran con inóculos altos que requieren la evacuación de colecciones, si las hubiere, ya que, de lo contrario, los tratamientos antibacterianos no son exitosos. Por este motivo, no debemos olvidar que el drenaje de las colecciones purulentas incide decididamente, en la evolución de los pacientes y en la respuesta antibiótica15.
La prevalencia, no despreciable, de SAMS-CA encontrada en nuestra investigación, nos hace proponer el agregado de oxacilina a la cobertura con glucopéptidos en los pacientes graves o con lesiones de rápida progresión.
A pesar de que la clindamicina es un antibiótico recomendado para uso en pacientes con infecciones por SAMR-CA, existen reportes que alertan sobre el aumento de resistencia del SA a este antibiótico a cifras tan altas como 25 %26.
Nuestro porcentaje de resistencia a la clindamicina es bajo, por lo que aún es una alternativa viable en pacientes clínicamente estables.
Otros antibióticos tales como TMP-SMZ, quinolonas y rifampicina son opciones válidas por el bajo porcentaje de resistencias, haciendo la salvedad de que las quinolonas no deben ser utilizadas sin restricciones en pediatría y de que las rifampicinas no pueden ser utilizadas como monoterapia, ya que, de ser utilizada de ese modo, desarrolla resistencia en forma rápida25.
CONCLUSIONES
La prevalencia de SAMR-CA es elevada, lo que obliga a plantear antibiótico empírico inicial para este germen, sin descuidar la cobertura de los SAMS-CA.
La baja prevalencia de resistencia de los SAMR-CA a la clindamicina permite su uso en pacientes estables.
Además de la vancomicina, existen otras alternativas terapéuticas disponibles tales como el trimetroprim-sulfametoxazol, ciprofloxacina, rifampicina.