Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.14 no.1 Asunción Apr. 2016
https://doi.org/10.18004/Mem.iics/1812-9528/2016.014(01)64-069
Articulo Original/ Original Article
Detección molecular del Papilomavirus Humano de Alto Riesgo en el seguimiento de mujeres tratadas por lesión escamosa intraepitelial
Molecular Detection of High Risk Human Papillomavirus in following women treated for squamous intraepithelial lesion
*Maria Liz BobadillaI, Veronica VillagraI, Maria E. ZorrillaI, Pablo PrattI, Gladys OlmedoI, Gladys RoscherII, Francisco FrancoII, María C. RiverosII
I Laboratorio Central de Salud Pública (LCSP), Ministerio de Salud Púbica y Bienestar Social (MSP Y BS). Asunción, Paraguay
II Hospital San Pablo (HSP), Ministerio de Salud Púbica y Bienestar Social (MSP Y BS). Asunción, Paraguay
R E S U M E N
El cáncer de cuello uterino (CCU) es la primera causa de muerte por cáncer en mujeres en países en vías de desarrollo. La infección persistente por el virus papiloma humano (VPH) es un factor necesario en lesiones preneoplásicas y CCU. La citología cervicovaginal es el método mayormente utilizado para detectar el CCU y su uso combinado con la de detección de ADN viral seis meses post-tratamiento aumenta la efectividad para identificar mujeres tratadas con riesgo de lesión residual/recidiva. El objetivo fue describir la frecuencia de VPH de alto riesgo (AR) en mujeres tratadas por lesión escamosa intraepitelial (SIL) que acudieron al Servicio de Patología Cervical del Hospital San Pablo de enero-diciembre/2014. Se realizó un estudio descriptivo de corte transverso, que incluyó 80 pacientes que acudieron al servicio para control post-tratamiento por SIL. Se utilizó Cobas 4800 HPV Test (Roche) para la detección individual de VPH-16 y 18, y un pool de 10 VPH-AR (31,33,35,39,45,51,52,56,58,59) y dos de “probable” alto riesgo (66,68). Se encontró infección viral en el 7,5% (6/80) de las pacientes tratadas; identificándose VPH-16 en 3/6 de los casos positivos. EnParaguay existe alta incidencia de lesiones pre-neoplásicas y CCU siendo un problema de salud pública. Los datos observados sugieren que la utilización de este sistema para la detección viral puede llevar a optimizar el seguimiento post-tratamiento y la identificación de VPH-16 y 18 podría contribuir a la selección de pacientes en mayor riesgo de desarrollar una lesión cervical que deben someterse a una vigilancia frecuente y meticulosa.
Palabras clave: virus papiloma humano (VPH), lesión escamosa intraepitelial (SIL), Cobas 4800 HPV Test, control post-tratamiento.
A B S T R A C T
Cervical cancer is the leading cause of cancer death in women in developing country. Persistent infection with human papillomavirus (HPV) is a necessary factor in premalignant lesions and cervical cancer. The Pap smear is the method most commonly used to detect the cervical cancer and its combined with the detection of viral DNA six months post-treatment increases effectiveness to identify women treated in risk with residual/recurrent lesion. The aim was to describe the frequency of high-risk HPV (HR) in treated women for squamous intraepithelial lesion (SIL) who attended the Cervical Pathology Service of Hospital San Pablo from January to December/2014. It is cross sectional, descriptive study which included 80 patients who attended the service for post-treatment control. The 4800 Cobas HPV Test (Roche) was used, which detects HPV-16 and 18, and a pool of 10 HR-HPV (31,33,35,39,45,51,52,56,58,59) and two "probable" high risk (66,68). Viral infection was found in 7.5% (6/80) of patients treated; identifying HPV-16 in 3/6 of positive cases. In Paraguay there is a high incidence of pre-neoplastic lesions and cervical cáncer remains a public health problem. The observed data suggest that the use of this system for viral detection can lead to optimize the post-treatment monitoring and the identification of HPV-16 and 18 could contribute to the selection of patients at increased risk of developing cervical injury should undergo to frequent and careful monitoring.
Keywords: Human Papilloma Virus, squamous intraepithelial lesion (SIL) COBAS 4800 HPV Test, post-treatment control.
INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es el tercer tipo de cáncer más común que afecta a las mujeres en el mundo y primera causa de muerte por cáncer en mujeres en países en vías de desarrollo. Se estiman 528.000 casos nuevos y 266.000 muertes al año. En Paraguay, según datos del Globocan 2012, se observa una tasa de incidencia 34,2 por 100.000 mujeres y una tasa de mortalidad de 15,7 por 100.000 mujeres, una de las más elevadas en Latino América (1).
La infección persistente por el virus papiloma humano (VPH) es un factor necesario para el desarrollo de lesiones preneoplásicas y CCU (2). La infección por VPH, por lo general ocurre a través de las relaciones sexuales (3). Está demostrado que más del 90% de las nuevas infecciones por VPH, incluso por tipos de alto riesgo, desaparecen espontáneamente dentro de los dos años del inicio de la infección (4-7).
Actualmente, no existe tratamiento para eliminar la infección por el VPH, pero sí para las lesiones producidas por este virus que deben ser tratadas para evitar su evolución a un cáncer invasor (5-7). El CCU es una enfermedad progresiva, que comienza como una lesión intraepitelial y evoluciona a una neoplasia invasora. La etapa intraepitelial incluye a las lesiones escamosas intraepitelial de bajo (LSIL) y alto grado (HSIL). El objetivo primordial de todo el programa de prevención del CCU es la detección y tratamiento oportunos de las lesiones preneoplásicas.
El 60% de las displasias leves o LSIL se resuelven espontáneamente, sólo aproximadamente el 15% progresan a HSIL o displasias moderadas o graves (8). En general, las LSIL son derivadas a colposcopía para su evaluación. Existe controversia sobre el manejo de estas lesiones, pero deben tratarse si cabe la posibilidad de que la mujer no regrese al servicio para el seguimiento, así como pacientes inmunocomprometidas o con diagnóstico cito-colposcópico persitente de LSIL (9).
El tratamiento recomendado para las HSIL es la conización cervical del cuello uterino en todas sus formas (fría o quirúrgica, láser, radiofrecuencia o LEEP) (9-10). La conización LEEP, es actualmente el procedimiento de elección, por su simplicidad de ejecución, es ambulatorio, de bajo costo, escasas complicaciones y los buenos resultados a corto y largo plazo (11-12).
El éxito de los tratamientos actuales suele darse en más del 95% de los casos, sin embargo, el seguimiento post-tratamiento es necesario, pues existe posibilidad de recidiva o de desarrollar CCU. La razón acumulada de invasión en 8 años post-tratamiento es de 5,8 por 1000 mujeres, cinco veces mayor que lo observado en población general (13-14).
Estos datos indican la importancia del continuo seguimiento de las pacientes tratadas. El estudio citológico cervicovaginal es el método mayormente utilizado para detectar el CCU. Sin embargo, con el uso combinado de la citología y el test de detección de ADN viral a los seis meses post-tratamiento, se obtiene un aumento en la efectividad para identificar mujeres tratadas con riesgo de desarrollar lesión escamosa intraepitelial residuales y recidivas (15).
El objetivo del trabajo fue describir la frecuencia de VPH-AR en mujeres tratadas por SIL de cuello uterino en el Servicio de Patología Cervical del Hospital San Pablo del Ministerio de Salud Pública y Bienestar Social (MSPyBS), de enero a diciembre de 2014.
MATERIALES Y MÉTODOS
Estudio descriptivo de corte transverso, realizado en mujeres tratadas por SIL en el Servicio de Patología Cervical del Hospital Materno-Infantil San Pablo del MSP y BS, de enero a diciembre de 2014. Este servicio, como parte del Programa Nacional de Prevención del Cáncer de Cuello Uterino, constituye un centro de referencia para el diagnóstico y tratamiento de las lesiones precursoras del cáncer de cuello uterino.
Se incluyeron 80 mujeres con diagnóstico cito-histológico previo de SIL, realizado en servicios de Anatomía Patológica del MSP y BS, clasificado según Bethesda 2001 (16). Previo al tratamiento, el 81% (65/80) presentó diagnóstico confirmado de LSIL y el 19% (15/80) de HSIL. Estas pacientes fueron tratadas por lo menos seis meses antes a la toma de muestra para la pesquisa de VPH-AR y se encontraban en seguimiento post-tratamiento. El procedimiento al que fueron sometidas las pacientes dependió del criterio médico basado en las recomendaciones nacionales vigentes (9).
En general, el control de las pacientes tratadas se realiza mediante citología cervical y colposcopía cada seis meses por dos años. A las pacientes incluidas en este estudio se les realizó también el test de VPH-AR a los seis meses post-tratamiento. Aquellas con resultados positivos para el test de VPH-AR se sometieron a la re-evaluación de la lesión y tratamiento acordes a las recomendaciones nacionales e internacionales. Sin embargo, a aquellas pacientes con resultados negativos para el test de VPH-AR se les recomendó seguir con el esquema habitual de controles (9,17).
Las participantes firmaron un consentimiento informado y respondieron un cuestionario sobre características clínico-demográficas y factores de riesgos asociados al CCU. El protocolo de este estudio fue revisado y aprobado previamente por el Comité de Ética en Investigación del Laboratorio Central de Salud Pública (LCSP).
Los especímenes clínicos consistieron en células exfoliadas recolectadas usando un cepillo citológico para endocervix. Una vez tomada la muestra, se hizo girar el cepillo suavemente unas tres a cuatro veces para desprender las células exfoliadas dentro del vial que contiene el medio para recolección de células Cobas PCR Cell Collection Media (Roche Diagnostics, Mannheim, Germany).
La detección de VPH se realizó en el LCSP utilizando Cobas 4800 HPV Test (Roche Diagnostics, Mannheim, Germany), aprobado por FDA en el 2011 y que consiste en un ensayo cualitativo por PCR en tiempo real totalmente automatizado que permitió la detección individual de los VPH-16 y VPH-18 y de un pool de 10 genotipos de alto riesgo (31, 33, 35, 39, 45, 51, 52, 56, 58 y 59) y dos de probable alto riesgo (66 y 68). Este sistema está compuesto por Cobas x 480, con el que se realizó la extracción y purificación simultánea de ADN del VPH y ADN celular a partir de las muestras cervicales sin tratamiento previo como indica el fabricante; y Cobas z 480, con el cual se realizó detección del ADN de los VPH-AR mediante la amplificación de una secuencia de 200 pares de bases de la región L1 del genoma del VPH y del gen de la b-globina humana mediante la amplificación de una secuencia de 330 pares de bases usada como control interno para validación del proceso. Sondas TaqMan® marcadas con cuatro diferentes fluoróforos fueron utilizadas para la detección de los productos amplificados durante la PCR y finalmente los resultados fueron interpretados por el software como “negativo”, “VPH-16”, “VPH-18”, “otros VPH-AR” o la combinación de los tres últimos.
Los datos fueron codificados para mantener la confidencialidad de los mismos y se realizó un análisis descriptivo de las características epidemiológicas de las pacientes calculando las medias y las desviaciones estándar para las variables cuantitativas, frecuencias y porcentajes para las cualitativas utilizando herramientas estadísticas de Microsoft Excel 2010.
RESULTADOS
La edad promedio de las pacientes estudiadas fue de 35 ± 13,1 años, con un rango etario de 21 a 63 años. Con respecto a la conducta sexual y factores de riesgo asociados al CCU, se observó que el inicio de las relaciones sexuales fue en promedio a los 18 ± 7,4 años, el 47% de las pacientes indicó haber tenido más de una pareja sexual, el uso de anticonceptivos hormonales fue referido por el 15,7% y se declararon fumadoras 2,4% de ellas.
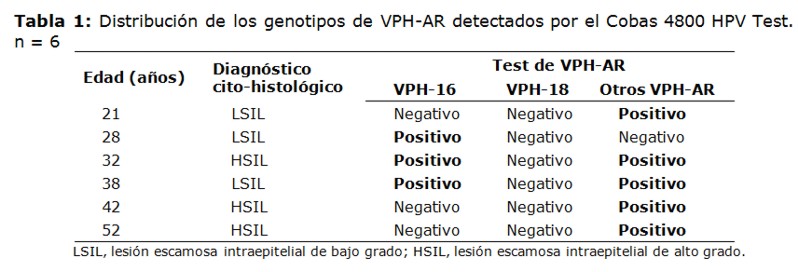
Se detectó infección viral en el 7,5% (6/80) de las pacientes tratadas por SIL incluidas en este estudio. De ellas, tres tenían diagnóstico previo de LSIL y tres de HSIL. La frecuencia de VPH-AR fue mayor en mujeres con diagnóstico previo de HSIL, 20% (3/15) que en mujeres con diagnóstico previo de LSIL, 4,6% (3/65).
El VPH-16 estuvo presente en el 50% (3/6) de los casos positivos. No fueron detectadas infecciones con el VPH-18. Se observaron co-infecciones de VPH-16 con por lo menos uno de los otros VPH-AR detectados por el sistema, en el 33% (2/6) de los casos positivos (Tabla 1).
DISCUSIÓN
El Paraguay es un país con alta incidencia de lesiones pre-neoplásicas y CCU, por lo que constituye un problema de salud pública. En un esfuerzo por aumentar las capacidades de detección/diagnóstico de VPH a nivel nacional, el MSP y BS instaló en el 2013 el sistema Cobas 4800 HPV Test (Roche Diagnostics, Alemania) en el LCSP. Este estudio muestra los primeros resultados de la utilización de la prueba en el seguimiento de mujeres tratadas por SIL.
Se observó que sólo seis de las pacientes tratadas fueron positivas para VPH-AR, sugiriendo riesgo de presentar una lesión residual/recurrente; similar a lo encontrado en un estudio realizado a nivel nacional en mujeres tratadas por SIL, que reportó una frecuencia de 28% para VPH-AR detectados por captura híbrida II (18).
El seguimiento a largo plazo después de un tratamiento local por SIL es obligatorio y ha sido recomendado por guías de consenso (19,20). Sin embargo, a pesar de la importancia de la detección precoz de un posible fallo en el tratamiento aplicado a las pacientes con lesiones precancerosas, no existe un consenso sobre el tiempo de seguimiento de las mismas.
Algunas guías internacionales sugieren dos opciones para el manejo post-tratamiento de pacientes con SIL el test de VPH a los 6 y 12 meses o citología/colposcopía a los 6 meses (20-22).
Las pruebas de ADN del VPH han sido utilizadas en numerosos estudios de post tratamiento y constituye una herramienta con varias ventajas sobre la citología (19,20). Se han analizado la sensibilidad y especificidad de este test, comparado con la citología, para la detección de lesiones residuales/recurrentes post-tratamiento; resultando el test de VPH más sensible que la citología y con especificidad similar (23,24).
Ciertos factores de riesgo han sido asociados a la aparición de lesiones residuales/recurrentes post-tratamiento; como la edad, paridad, citología previa, estadío de la lesión, genotipo viral, entre otros (23,25). La infección con VPH-16 presenta mayor riesgo de recurrencia durante el tratamiento de displasias severas (26).
Datos más recientes demostraron que la presencia de VPH-16, 18, 33 ó 45 antes del tratamiento, está asociado a una frecuencia más elevada de lesión residual/recurrente (27). La detección de VPH-16 a los 6 meses post-tratamiento está asociada a un riesgo absoluto de CIN 2 ó más a los dos años, del 37%, dos veces más que para el VPH-18 del 18,5% y tres veces más que para otros tipos oncogénicos del 10,8% (28,29). Por lo expuesto, la utilización de una prueba de detección de ADN de VPH-AR que identifique separadamente los genotipos 16 y 18 podría contribuir a identificar mujeres en mayor riesgo.
A pesar de que el presente trabajo posee algunas limitaciones como el tamaño de la muestra analizada y que no se contaron con resultados de VPH-AR previo al tratamiento, los datos presentados sugieren que la utilización del Cobas 4800 HPV Test para la detección del ADN viral, en conjunto con la citología, pueden llevar a la optimización del seguimiento post-tratamiento y a la selección rápida y eficiente de un subgrupo de pacientes, que posee una infección persistente con un mayor riesgo de desarrollar una lesión cervical que deben ser sometidas a una vigilancia frecuente y meticulosa. Por el contrario, aquellas con una prueba de VPH-AR negativa post-tratamiento se relacionan con un valor predictivo negativo de casi el 100%, lo que permitiría aumentar el intervalo de tiempo de los controles y colocar a la paciente en un seguimiento de rutina (17).
REFERENCIAS BIBLIOGRAFICAS
1. International Agency for Research on Cancer. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. Disponible en http://globocan.iarc.fr/ [ Links ]
2. Muñoz N, Castellsagué X, de Gonzalez AB, Gismann L. Chapter1: HPV in the etiology of human cancer. Vaccine 2006;24(S3):1-10. [ Links ]
3. Franco E, Villa L, Sobrinho J, Prado JM, Rousseau M-C, Desy M, et al. Epidemiology of acquisition and clearance of cervical human papillomavirus infection in women from a high-risk area for cervical cancer. J Infect Dis. 1999;180:1415-23. [ Links ]
4. Molano M, Van den Brule A, Plummer M, Weiderpass E, Posso H, Arslan A et al. Determinants of clearance of human papillomavirus infections in Colombian women with normal cytology: a population-based, 5-year follow-up study. Am J Epidemiol. 2003;158:486-94. [ Links ]
5. Winer R, Lee S, Hughes J, Adam D, Kiviat N, Koutsky L. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol. 2003;157:218-26. [ Links ]
6. Goodman MT, Shvetsov YB, McDuffie K, Wilkens LR, Zhu X, Thompson PJ, et al. Prevalence, Acquisition, and Clearance of Cervical Human Papillomavirus Infection among Women with Normal Cytology: Hawaii Human Papillomavirus Cohort Study. Cancer Res. 2008 Nov 1; 68(21): 8813-24.doi: 10.1158/0008-5472.CAN-08-1380 [ Links ]
7. Moscicki AB. Impact of HPV infection in adolescent populations. J Adolesc Health. 2005; 37:3-9. [ Links ]
8. Ho G, Burk R, Klein S, Kadish A, Chang C, Palan P et al. Persistent genital human papillomavirus infection as a risk factor for persistent cervical dysplasia. J Natl Cancer Inst 1995;87:1365-71 [ Links ]
9. Köse F , Naki MM. Cervical premalignant lesions and their management. J Turk Ger Gynecol Assoc. 2014;15:109-21. [ Links ]
10. Paraguay. Ministerio de Salud Pública y Bienestar Social.Manual Nacional de Normas y Procedimientos para la Prevención y el Control del Cáncer de Cuello Uterino. Asunción: OPS/OMS; 2010 [ Links ]
11. Martin P, Paraskevaidis E, Bryant A, Dickinson H, Keep S. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2010;12:CD001318. doi: 10.1002/14651858.CD001318.pub3 [ Links ]
12. Cox JT. Management of cervical intraepithelial neoplasia. Lancet 1999;353(9156):857-9. DOI: http://dx.doi.org/10.1016/S0140-6736(98)00392-4 [ Links ]
13. Ferenczy A, Choukroun D, Arseneau J. Loop electrosurgical excision procedure for squamous intraepithelial lesions of the cervix: advantages and potential pitfalls. Obstet Gynecol 1996;87(3):332-7. [ Links ]
14. Carvalho MO, Almeida R, Leite F. Detection of Human Papillomavirus DNA by the Hybrid Capture Assay. Braz J Infect Dis. 2003;7(2):121-5. [ Links ]
15. Kucera E, Sliutz G, Czerwenka K, Breitenecker G, Leodolter S, Reinthaller A. Is high-risk human papillomavirus infection associated with cervical intraepithelial neoplasia eliminated after conization by large-loop excision of the transformation zone. Eur J Obstet Gynecol Reprod Biol. 2001;100(1):72-6. [ Links ]
16. Park JY, Bae J, Lim M, Lim S, Lee DO, Kang S et al. Role of high risk-human papilloma virus test in the follow-up of patients who underwent conization of the cervix for cervical intraepithelial neoplasia. J Gynecol Oncol 2009;20(2):86-90. [ Links ]
17. Solomon D, Davey D, Kurman R, Moriarty A, O'Connor D, Prey M, et al. The 2001 Bethesda System: Terminology for Reporting Results of Cervical Cytology. JAMA. 2002;287(16):2114-9. [ Links ]
18. Wrigth TC, Schiffman M, Solomon D, Cox T, García F, Goldie S et al. Interim guidance for the use of human papillomavirus DNA testing as an adjunct to cervical cytology for screening. Obstet Gynecol. 2004:103(2):304-9. [ Links ]
19. Mongelos P, Paez M, Rodriguez I, Gimenez G, Castro A, Mendoza L. Deteccion del virus del papiloma humano de alto riesgo por captura hibrida II segun hallazgos citologicos en mujeres tratadas por lesiones escamosas intraepiteliales de cuello uterino, periodo 2006/2010. Rev. bras. epidemiol. 2013;16(1):40-8. [ Links ]
20. Soutter WP,Sasieni P,Panoskaltsis T. Long-term risk of invasive cervical cancer after treatment of squamous cervical intraepithelial neoplasia. Int J Cancer.2006;118(8):2048-55. [ Links ]
21. World Health Organization .WHO guidelines for screening and treatment of precancerous lesions for cervical cancer prevention.Ginebra: World Health Organization; 2013. [ Links ]
22. Wright TC, Massad LS, Dunton CJ, Spitzer M, Wilkinson EJ, Solomon D et al. 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol. 2007;197(4):340-5. [ Links ]
23. Strander B, Andersson-Ellström A, Milsom I, Sparén P. Long term risk of invasive cancer after treatment for cervical intraepithelial neoplasia grade 3: population based cohort study.BMJ. 2007;335(7629):1077. [ Links ]
24. Alonso I, Torne A, Puig L, Esteve R, Quinto L, Campo E et al. Pre- and post-conization high-risk HPV testing predicts residual/recurrent disease in patients treated for CIN 2-3. Gynecol Oncol 2006;103(2):631-6. [ Links ]
25. Houfflin DV, Collinet P, Vinatier D, Ego A, Dewilde A, Boman F et al. Value of human papillomavirus testing after conization by loop electrosurgical excision for high-grade squamous intraepithelial lesions. Gynecol Oncol. 2003;90(3):587-92. [ Links ]
26. Costa S, De Simone P, Venturoli S, Cricca M, Zerbini ML, Musiani M et al. Factors predicting human papillomavirus clearance in cervical intraepithelial neoplasia lesions treated by conization. Gynecol Oncol 2003;90:358-65. [ Links ]
27. Gök M, Coupé V, Berkhof J, Verheijen R, Helmerhorst T, Hogewoning C et al. HPV16 and increased risk of recurrence after treatment for CIN. Gynecol Oncol. 2007;104(2):273-5. [ Links ]
28. Wu D, Zheng Y, Chen W, Guo C, Yu J, Chen G et al. Prediction of residual/recurrent disease by HPV genotype after loop excision procedure for high-grade cervical intraepithelial neoplasia with negative margins. Aust N Z J Obstet Gynaecol. 2011;51(2):114-8. [ Links ]
29. Kreimer AR, Guido RS, Solomon D, Schiffman M, Wacholder S, Jeronimo J et al. Human Papillomavirus Testing Following Loop Electrosurgical Excision Procedure Identifies Women at Risk for Posttreatment Cervical Intraepithelial Neoplasia Grade 2 or 3 Disease. Cancer Epidemiol Biomarkers Prev. 2006;15(5):908-14. [ Links ]
Fecha de recepción: noviembre 2015. Fecha de aceptación: febrero 2016
Autor correspondiente: *Maria Liz Bobadilla Laboratorio Central de Salud Pública (LCSP), Ministerio de Salud Púbica y Bienestar Social (MSP Y BS).
Email: bobadillaml@gmail.com