INTRODUCCIÓN
La infección por el Citomegalovirus (CMV) es frecuente en los primeros años de vida en los países subdesarrollados y en estratos bajos de los países desarrollados. El CMV constituye, en la actualidad, la primera causa de infección intrauterina asociada a malformaciones congénitas1. La trasmisión materno fetal puede ocurrir durante la enfermedad aguda o reactivación de infección pasada de la madre. De todos los recién nacidos afectados por el virus un 10 a 15% serán sintomático. La infección puede adquirirse de forma vertical (transplacentaria); un 5% durante el pasaje a través del canal del parto y durante la etapa postnatal precoz mediante la lactancia materna (60%) o transfusiones sanguíneas2.
Los síntomas de infección son diversos: bajo peso al nacer, hepato -esplenomegalia, trombocitopenia, microcefalia y trastornos neurológicos. La infección congénita por CMV se asocia a discapacidad permanente, siendo la primera causa de hipoacusia neuro-sensorial (HNS) no genética (15 a 25%) y retraso psicomotor1. La importancia de una detección temprana y precisa de la infección por el CMV, permite iniciar el tratamiento con ganciclovir intravenoso durante 6 semanas a fin de prevenir el desarrollo de hipoacusia progresiva, así como las alteraciones en el lenguaje y aprendizaje, en los niños con infección congénita sintomática por CMV3,4. De no recibir tratamiento, hasta un 87% de los niños afectados congénitamente, pueden desarrollar discapacidad auditiva.
En pacientes hospitalizados la primo infección o reactivación, se confirma por la presencia de los síntomas en el paciente y estudios de laboratorio específicos que detectan las partículas virales en circulación como la PCR o el aislamiento viral en cultivos celulares1.
La infección congénita por CMV se confirma cuando se aísla el virus de la orina o saliva en las 3 primeras semanas de vida. El virus adquirido a través de la leche materna, probablemente tiene poco impacto en niños a término, pero si en los prematuros, ya que puede afectar su desarrollo neurológico a largo plazo1.
Los recién nacidos infectados por CMV, cualquiera sea la vía de contagio, pueden excretar el virus, incluso hasta el año de vida (8-60%). Si el virus en orina se detecta luego de las tres semanas de vida, resulta difícil establecer si se trata de infección connatal o adquirida5. La excreción viral prolongada se asocia a infección post natal, adquirida en el canal del parto o por leche materna6.
El cultivo rápido del virus a través de la técnica de Shell vial, permite la detección del CMV en orina; sin embargo esta técnica es laboriosa y compleja, por lo que actualmente no constituye el método de primera elección para el diagnóstico7.
La técnica de reacción en cadena de la polimerasa (PCR), que surgió como una alternativa diagnóstica válida, se realiza en orina, sangre, LCR y saliva en el recién nacido como prueba de tamizaje. En la actualidad la PCR se constituye en el standard de oro, al detectar la región constante ApoB del genoma viral, con buen nivel de sensibilidad, aunque la detección, no siempre implica replicación viral. Sin embargo esta sensibilidad es menor en saliva y LCR debido a la baja excreción viral5.
La prevalencia a nivel mundial de infecciones congénitas por CMV, oscila de entre 0.5 a 2.4% en recién nacidos vivos, 5 a 10% en lactantes infectados in útero, con tasas de 0.5 a 1% en USA y de 0.3 a 0.6% en Europa3. En Latinoamérica algunos datos de prevalencia de CMV en menores revela: 83% en Venezuela3, en Chile 1.7%8, 0.5 a 2.4% de RN vivos en México9, un 90% de infección primaria en menores de 18 años en Cuba8 y 52% en nuestro país por PCR también en menores de 18 años10.
En el país no existen reportes de prevalencias de la infección por CMV en lactantes menores.
El objetivo del presente estudio fue conocer la prevalencia de infección por CMV con la identificación del genoma viral del Citomegalovirus mediante la Reacción en Cadena de Polimerasa (PCR) en lactantes de 0 a 12 meses con sospecha de infección congénita, admitidos en hospitales de referencia del departamento central de la República del Paraguay.
MATERIALES Y MÉTODOS
Estudio observacional, descriptivo, transversal y retrospectivo realizado con muestras sanguíneas provenientes de pacientes hospitalizados en centros públicos y privados de Asunción y Departamento Central. Realizado en el periodo de enero del 2015 a Mayo de 2017.
Fueron ingresados al estudio todos los pacientes de 0 a 12 meses de edad con sospecha de infección sintomática congénita o adquirida por CMV, por historia prenatal o serología materna sugerente de infección primaria, procedentes de salas de cuidados intensivos. Fueron excluidas las muestras sanguíneas consideradas deficientes por cantidad o por trasporte inadecuado, que pudieran comprometer los resultados. Las variables estudiadas fueron edad en meses, procedencia, signos y síntomas y resultados de la PCR para CMV.
Los datos de los pacientes fueron registrados en una hoja de captación de datos confeccionada especialmente para el efecto. Las hojas de captación y las muestras sanguíneas con EDTA de los pacientes, fueron remitidas a un laboratorio de referencia de virología y procesadas por un especialista del área.
La extracción del ADN se realizó con el Kit comercial Promega®, acorde a las instrucciones del fabricante seguido de una PCR en tiempo real. Este último método se realizó de acuerdo al protocolo modificado de Casas y Tenorio para la detección del gen de expresión temprana UL54, en el equipo Rotor Gene®. El volumen final de reacción fue de 20 ul, se utilizó una Master mix Sso Fast Eva Green Supermix de Bio Rad®, con una ronda de reacción de 35 ciclos de 94°C por 5 min, 94°C por 15 seg, 49°C por 15 seg., 72°C por 15 seg. y una extensión final de 72°C por 5min. Los primeros utilizados que detectan un producto de 78 pb fueron sintetizados por Invitrogen®. El límite de detección fue de 5 copias/ml, se utilizaron controles positivos y negativos de procedencia comercial Artus.® Los resultados se informaron Detectables y No detectables, previo análisis de la curva de meelting. El resultado detectable o positivo de la PCR para CMV se consideró indicativo de infección. La sensibilidad y valor predictivo negativo de la prueba es de 100%, la especificidad de 78%.
Para el análisis e interpretación de las variables, se transcribieron a una planilla electrónica en el formato Microsoft Excel 2010, utilizando la estadística descriptiva mediante el programa estadístico Epi Info.7® y expresados en tablas a manera de frecuencias absolutas y relativas.
Aspectos éticos
Se respeto en todo momento los principios éticos que rigen los estudios en seres humanos. Los padres firmaron el consentimiento informado para realización de prueba en materiales biológicos. Se respetaron los principios de beneficencia y justicia, no se realizó ninguna intervención y tampoco implicó ningún riesgo para los pacientes.
RESULTADOS
Se incluyeron los resultados de 146 muestras de sangre de niños de ambos sexos, menores de un año realizados por PCR en tiempo real para detección de CMV. Las características de grupo etario procedencia y prematurez se observan en la Tabla 1 De la población de prematuros, el 13,4%(12/89) , tenían antecedente de serología materna positiva para CMV
En el 42,5% (62/146) se detectó el ADN viral del CMV por la PCR. De los 62 casos positivos 35,4% (22/62) fueron niñas, 53,3 %(33/62) niños, 11,3%(7/62) sin datos en cuanto al sexo. Un 17,7% (11/62) fueron recién nacidos de pretermino, de los cuales 8/11 eran hijos de madres con serología positiva para CMV y se considero como CMV congénito.
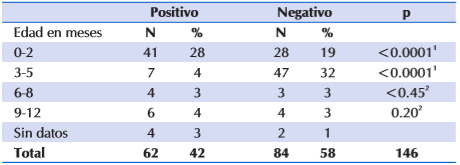
La prevalencia de casos positivos según grupo etario se encuentra en la Tabla 2.
Tabla 1 Datos del grupo etario, procedencia y prematurez de los pacientes cuyas muestras de sangre fueron estudiadas, N=146.

Tabla 2 Distribución etaria de las muestras, y resultados de PCR, de los lactantes hospitalizados con sospecha de infección por CMV, N= 146.
1= x2
2= Test Fisher
Los principales hallazgos clínicos en los pacientes cuyas muestras fueron estudiadas por sospecha de infección por CMV se encuentran en la Tabla 3.
Tabla 3 Comparación de las características clínicas de los lactantes cuyas muestras fueron estudiadas para la detección de CMV por PCR, N=146.

*Trastornos hematológicos: Trombocitopenia, Leucopenia, coagulopatias, petequias.
**(Chi cuadrado y corrección de Yates)
Entre los hallazgos menos frecuentes o indeterminados se reportaron fiebre, infecciones varias, sepsis.
DISCUSIÓN
La prevalencia del Citomegalovirus en sangre en 42 % de nuestros pacientes hospitalizados en cuidados intensivos, en los cuales se estableció sospecha clínica, debe llamar la atención. Esta prevalencia en prematuros del 17 %, con un 28% en lactantes menores de 28 días, resulto ser más elevada que la reportada por otros autores11,12.
A pesar de que en la mayoría de los ingresados en el estudio, fueron menores de 2 meses 109 (75 %), de ellos, en el 28% que se detectó el CMV, se podría asociar a infección congénita. La concordancia de la serología materna con el PCR para CMV en el niño no fue estudiada, ya que es conocido que la serología posee baja sensibilidad y especificidad para detectar la enfermedad.
No pudimos precisar si la prevalencia alta se debe a que se incluyeron todos los niños hasta el año, o que la infección haya sido adquirida en forma horizontal a través de los meses de vida. En este punto, es importante mencionar que las trasfusiones sanguíneas recibidas, los recién nacidos para mejorar su estado crítico, pudieron haber contribuido también. Este hecho puede hacer que nuestra prevalencia resulte mucho mayor que el reportado por la literatura, que refiere hasta el 60% de niños con antecedentes de infección congénita por CMV, pueden seguir excretando el virus por la orina hasta el año de edad13.
Por otro lado, este estudio pretendió establecer las prevalencias de la detección del CMV y no la causalidad de la enfermedad, ya que la sintomatología de los pacientes estudiados podría deberse a otro tipo de infecciones tales como sepsis o enfermedades del grupo STORCH14, que evaluados con el laboratorio y el resultado de PCR, posibilitaron tomar la mejor decisión terapéutica.
Aunque la prevalencia de 42% encontrada es elevada comparada con los citados precedentemente, creemos que la misma puede estar subestimada, ya que la viremia es oscilante en sangre, comparada con la mayor y persistente excreción viral que se observa en orina, que es la muestra de elección15.
Nuestra prevalencia en prematuros del 28% fue mayor a la casuística Española, que reporto un 10% de confirmación del CMV mediante la PCR y antigenemia16. Aunque la PCR tiene 90 a 98 % de sensibilidad y una especificidad de 92 a 98%, detecta los virus circulantes a pocos días de haberse establecido la infección en los RN asintomáticos o con pocos síntomas, la sensibilidad puede variar o disminuir con cargas virales bajas17,18. Otras casuísticas reportan un 100% pero utilizando sangre seca19, resulta variable en otros materiales biológicos como sangre, orina, LCR y en saliva11. Otra muestra también utilizada es el humor acuoso, mediante la PCR en tiempo real que resultó ser un método simple de confirmación de sospecha de infección por CMV en la primera consulta oftalmologica20.
Las prevalencias varían con los diferentes estudios y países, así tenemos en Bolivia con solo el 0.6% de detección13 y con 28 a 34% en el grupo de Boppaana y cols21. El estudio en Japón hecho en sangre y orina de niños con trastornos auditivos, demostró que la mayor carga carga viral no predice la aparición de Hipoacusia, pero si la excreción viral prolongada22. La asociación de Hipoacusia causada por CMV en esta casuística no pudo ser determinada, pero es recomendado el tamizaje de audición en los recién nacidos y lactantes a fin de diagnosticar esta afección en forma rápida23,24.
Existen diferentes tipos y marcas de reactivos para PCR en tiempo real25. Así el estudio multicentrico de Suresh y cols, realizado en Recién Nacidos, utilizando PCR en tiempo real con muestras de saliva liquida o seca, mostró sensibilidad, especificidad y valores predictivos positivos y negativos mayores al 90%, por lo que esta muestra podría ser recomendada para su uso como tamizaje26. Un estudio en Atlanta encontró más detecciones del CMV en saliva que en orina19.
La manifestación más frecuente reportada en este grupo fue la prematuridad en un 17 %, superior a lo reportado por los mejicanos, con 15,3% en prematuros extremos con 2,3% confirmadas congénitas8. La evaluación de niños prematuros extremos (<28 semanas de edad gestacional) al nacer ayuda, para buscar la asociación al CMV, así como a diferenciar entre infección congénita y postnatal27,23.
De las madres con serología positiva para CMV, se detectó PCR en 8 de los RN (66%). Sin embargo en este grupo de madres no se determinó si fue infección primaria o reactivación, siendo importante la prevención sobre todo en la seronegativas16,28. Aunque de un 70 a 88% de madres seropositivas que son excretoras de CMV por leche, solo 10% de los RN amamantados desarrollaran infección clínica aparente20, pero esta fuente de infección post natal, no lo hemos podido investigar29. La seroprevalencia que fue similar en madres excretoras o no, en el estudio en niños sanos en Atlanta, no permite considerarlo como un valor predictor24.
Varias debilidades pueden apuntarse en este estudio, tal como la falta de comparación con PCR realizado en orina (donde la viremia es constante), el gold estándar a fin de obtener sensibilidad y especificidad de la técnica utilizada26.
Por otro lado, es importante considerar que debido al estado de latencia y cronicidad que produce el CMV, no siempre se puede relacionar la infección activa detectada por técnicas moleculares con enfermedad, con lo cual, algunas de las detecciones de CMV pudieron haber sido solo excreción viral y no infección activa. Por ello hubiera sido importante el seguimiento de estos casos para evaluar el rol etiológico del CMV con los hallazgos clínicos además de una carga viral o un control post tratamiento en relación a los trastornos auditivos o neurológicos causados por el virus. Esta cuantificación para el CMV, también es recomendada cuando se evalúan a bebés sin ninguna otra manifestación de enfermedad por CMV14.
CONCLUSIÓN
Este estudio estableció una prevalencia de 42% de detección de infecciones congénitas atribuidas al CMV mediante la PCR en tiempo real en nuestro país, con muestras de sangre de los niños hospitalizados en cuidados intensivos en servicios de salud de capital y departamento central con la sospecha clínica, concentrándose los resultados positivos en los menores de 28 días (28%) y con diagnóstico de prematurez (17%).














