INTRODUCCIÓN
En la práctica clínica diaria, la interpretación de gases arteriales y el análisis de los desequilibrios ácido-base son una herramienta fundamental para la evaluación del estado clínico del paciente, ayuda a establecer diagnósticos diferenciales de su motivo de consulta y tiene un papel fundamental en la orientación terapéutica, por lo cual la habilidad de una adecuada interpretación de dicho paraclínico es fundamental para cualquier profesional de la salud. Teniendo en cuenta lo anterior el presente artículo de revisión busca brindar conceptos básicos, a la luz de la literatura médica actual, para una correcta y completa interpretación de los gases arteriales.
CONCEPTOS BÁSICOS
Desórdenes en el intercambio de O2 y CO2
El intercambio de oxígeno (O2) entre la atmósfera y la sangre, así como el paso de dióxido de carbono (CO2) entre la sangre y la atmósfera, conforman lo que conocemos como intercambio gaseoso (Figura 1). Este proceso se lleva a cabo entre los alvéolos y los capilares, a través de la membrana alveolo capilar, donde por diferencia de presiones parciales se favorece el paso de oxígeno del alveolo al capilar o viceversa en el caso del CO2. En este último escenario, la eliminación eficiente del CO2 se debe principalmente a la ventilación alveolar, que es el volumen total de aire que se mueve desde los alvéolos hacia el exterior en un minuto. Esto explica por qué, en condiciones normales, los niveles de presión arterial de C02 (PaCO2) se mantienen dentro de los rangos normales, incluso en situaciones de mayor producción de CO2. Sin embargo, cuando hay alteraciones en la ventilación alveolar, la PaCO2 puede elevarse significativamente1-5.
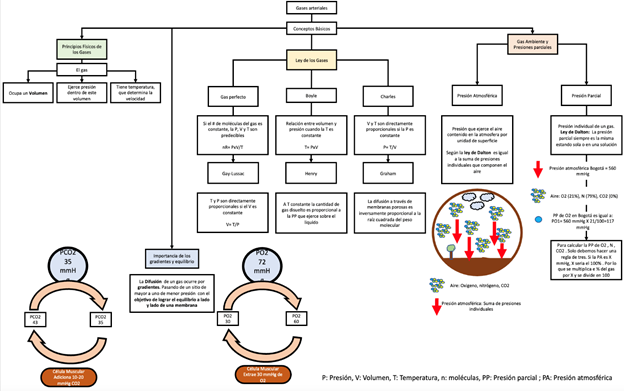
Figura 1. Fisiología del intercambio gaseoso. P: Presión, T: Temperatura, n: moléculas, PP: Presión parcial; PA: Presión atmosféricaContrario a la eliminación de CO2, el mantenimiento de niveles normales de presión arterial de O2 (PaO2) depende de varios factores. Al medir la PaO2, solo estamos considerando el oxígeno libre, que representa una pequeña cantidad del contenido arterial de oxígeno. Por lo tanto, al evaluar la homeostasis del oxígeno, debemos tener en cuenta: el oxígeno libre (PaO2), el oxígeno unido a la hemoglobina que se expresa como la saturación de oxígeno (SaO2) y la concentración de hemoglobina6,7.
La PaO2 tiene un impacto significativo en la saturación de O2 (SaO2). Podría pensarse que a medida que aumenta la PaO2, se obtendrán niveles más altos de SaO2. Sin embargo, esta relación no es lineal. Una vez que la hemoglobina se satura completamente con moléculas de oxígeno, un incremento adicional en la PaO2 no afectará la SaO2. Este concepto y otros factores que influyen en la afinidad del oxígeno por parte de la hemoglobina se representan en la curva de disociación de la oxihemoglobina8,9. Figura 2
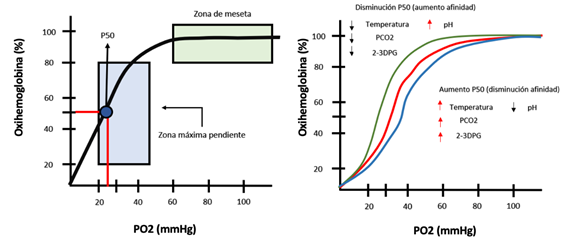
Figura 2. Curva de disociación de la oxihemoglobina. En condiciones normales, la meseta de la curva corresponde a PaO2 de 60-70 mmHg y saturaciones superiores a 90%, por el contrario, por debajo de 60 mmHg la reducción de PaO2 resulta en disminución importante de la saturación (Gráfica A). La desviación con relación al pH se denomina efecto Bohr (Gráfica B).
Si bien la curva de disociación de la hemoglobina (Hb) permite determinar los componentes que afectan la SaO2, estos no se extrapolan a los factores que determinan la PaO2. Por lo tanto, los tres factores que influyen en la PaO2 son: la relación ventilación/perfusión (V/Q), la fracción inspirada de oxígeno (FiO2) y la ventilación alveolar8,10.
Ventilación alveolar: Basados en los conceptos previamente descritos, existe una relación inversamente proporcional entre la PaCO2 y PaO2. Cuando aumenta la ventilación alveolar aumenta la salida de CO2 y consecuentemente hay una elevación de la PaO2. De forma contraria, en contextos de hipoventilación alveolar, el CO2 se acumula y disminuye la PaO2.
Ventilación/perfusión (V/Q): Es común que muchos esquemas representen al pulmón como un reservorio unicompartimental en el cual el oxígeno y la sangre capilar se distribuyen de manera homogénea. Sin embargo, esta representación es principalmente gráfica o simbólica, ya que la distribución de los alvéolos y capilares involucrados en el intercambio gaseoso es heterogénea. En algunas enfermedades, la distribución de las unidades alveolocapilares funcionales se ve alterada, lo que conlleva cambios en la relación V/Q, ya sea por áreas mal ventiladas (en los procesos neumónicos) y bien perfundidas (shunt) o áreas bien ventiladas y mal perfundidas (espacio muerto). Figura 3
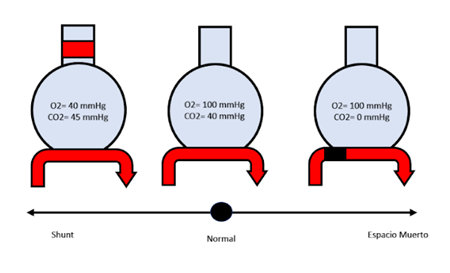
Figura 3. Alteraciones en la relación (V/Q) Ventilación/perfusión. Se observa de izquierda a derecha la representación de áreas bien perfundidas (Shunt), la distribución homogénea entre la relación V/Q (Normal) y áreas bien ventiladas y mal perfundidas (Espacio muerto).
Fracción inspirada de oxígeno FiO2: Hace referencia al porcentaje de O2 que se inspira del aire. La FiO2 normal es del 21% en el aire ambiente, y este valor se mantiene como una regla universal en cualquier parte del mundo. Por otro lado, la presión parcial de oxígeno (PO2) en una ciudad de mayor altitud será menor que al nivel del mar, lo que significa que la cantidad de oxígeno inspirado depende de la altitud y adicionalmente, del uso de dispositivos para modificar la FiO211.
Dentro de los trastornos de la oxigenación, es importante comprender algunos términos que pueden aclarar la interpretación de la literatura y permitir al lector utilizar los conceptos adecuadamente. Estos términos pueden parecer similares, por lo que tener claras sus diferencias es esencial. La hipoxia se refiere a un estado patológico en el cual los tejidos reciben un suministro inadecuado de oxígeno para mantener el metabolismo aeróbico normal. Esto puede ser resultado de una concentración insuficiente de oxígeno en la sangre arterial (hipoxemia) o de una insuficiente perfusión de sangre hacia los tejidos. Por otro lado, cuando se habla de alteración en la oxigenación, se hace referencia a una disminución en el suministro de oxígeno desde los pulmones hacia la sangre12,13,14.
Una vez que hemos comprendido estos conceptos, podemos caracterizar los principales tipos de insuficiencia respiratoria. La insuficiencia tipo 1 se caracteriza por niveles disminuidos de PaO2 con un valor normal o bajo de PaCO2, lo cual puede ser transitorio debido a una hiperventilación compensatoria. Esta forma de insuficiencia respiratoria se refiere a una alteración en la oxigenación, pero con una ventilación adecuada. Aunque podría esperarse que la SaO2 disminuya proporcionalmente con la disminución de la PaO2, debemos tener en cuenta la curva de disociación de la oxihemoglobina. Si la PaO2 se mantiene por encima de 60 mmHg, la reducción en la PaO2 no causa una disminución significativa en la SaO2. Sin embargo, una vez que se supera la zona de compensación completa y la PaO2 cae por debajo de 60 mmHg, se produce una reducción marcada en la SaO2 con cambios pequeños en la PaO215-18.
La insuficiencia tipo 2, en contraste, se caracteriza por un aumento en la PaCO2 y una reducción en la PaO2, siendo el aumento de la PaCO2 la característica principal de este tipo de insuficiencia respiratoria. Esta condición es causada por una alteración en la ventilación alveolar. Es importante destacar que toda insuficiencia tipo 1 eventualmente progresará hacia una insuficiencia tipo 2, ya que los mecanismos compensatorios son limitados y, por lo tanto, con el agotamiento de estos, se produce acumulación de CO215-18.
En la Tabla 1 se pueden diferenciar algunas enfermedades agudas y crónicas que pueden ser causantes de este tipo de insuficiencia, lo cual destaca la importancia de reconocer la causa para una interpretación adecuada de los gases arteriales (GA). Esto nos permite determinar si estamos frente a enfermedades crónicas, donde se espera un aumento compensatorio en los niveles de bicarbonato (HCO3) con un pH ligeramente disminuido o normal, lo cual no ocurre en enfermedades agudas15-18.
Tabla 1. Causas de insuficiencia tipo I y tipo II
| Compromsio Parenquimatoso | Obstruccion de la via aerea |
|---|---|
| Neumonia | Asma |
| Edema Pulmonar cardiogénico | Enfermedades neurologicas |
| Edema pulmonar no cardiogénico | Depresion respiratoria central |
| Hemorragia pulmonar | Daño medular |
| Enfermedad pulmonar intersticial | Compromiso del nervio perfierico |
| Embolismo pulmonar | Enfermedad muscular o de la union neuromuscular |
Fuente: Elaboración propia
Desórdenes en el equilibrio ácido base
Los iones de hidrógeno (Hidrogeniones H+) en una solución se pueden expresar en unidades de nanomoles por litro (nmol/L) o mediante el pH, que representa la concentración de H+ en una solución o el logaritmo negativo de la concentración de H+. Por lo tanto, una concentración alta de H+ se traduce en un pH bajo, lo cual indica que la solución es ácida. Por el contrario, una concentración baja de H+ se traduce en un pH alto, indicando que la solución es alcalina. En los seres humanos, el pH normal de la sangre oscila entre 7.35 y 7.45, lo cual corresponde a una concentración de H+ de 35 a 45 nmol/L. Un pH menor a 7.35 indica acidosis, mientras que un pH mayor a 7.45 indica alcalosis19-21.
Los H+ pueden provenir de varias fuentes como el metabolismo de las proteínas, lípidos y carbohidratos. La producción de CO2 ocurre en las células durante la glucólisis y el ciclo del ácido cítrico en el citoplasma y la mitocondria, respectivamente. Durante estas reacciones bioquímicas, la energía almacenada en los enlaces de carbono reducidos de grasas, azúcares y proteínas se libera gradualmente, hasta que todo el átomo de carbono se oxida y se combina con dos átomos de oxígeno para formar dióxido de carbono como producto final.
El dióxido de carbono se disuelve en la sangre y se convierte en ácido carbónico (H2CO3) a través de la acción de la enzima anhidrasa carbónica. El ácido carbónico se descompone en iones de H+ y bicarbonato (HCO3-). Por lo tanto, un aumento en los niveles de H+ puede ocurrir en situaciones en las que hay un incremento en la producción de CO2, una incapacidad para eliminar el CO2 y una disminución en la concentración de HCO3-, lo cual permite la acumulación de H+ en el organismo19-21.
Contamos de igual manera con múltiples mecanismos que nos permiten eliminar H+ siendo los más efectivos el control de la ventilación alveolar y la eliminación de moléculas que contribuyen a la acidosis por vía renal. En este último aspecto se espera que el riñón aumente la excreción de H+ y aumente la absorción de HCO3 lo cual se explicará de forma más clara a continuación19-21.
Mantenimiento de un pH Normal
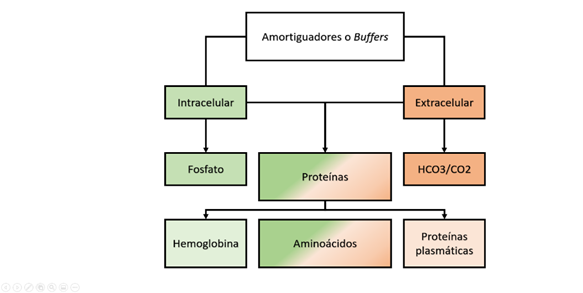
Para lograr la homeostasis el organismo debe eliminar todos los ácidos que son producidos, lo cual es llevado a cabo en mayor medida a nivel renal. No obstante, este proceso es lento, toma horas a días y por lo tanto, se requieren de otras estrategias para lograr el equilibrio. Así, los cambios en el pH son contrarrestados inicialmente por medio de los buffers o amortiguadores, los cuales incluyen al bicarbonato/dióxido de carbono (HCO3/CO2), el fosfato disódico/ fosfato monosódico (Na2HPO42-/NaH2PO4), la hemoglobina (HbO2/HbH) y las proteínas plasmáticas (Figura 4). El principal amortiguador extracelular es el HCO3/CO2, ambos elementos comprendidos en la ecuación de Henderson- Hasselbach, donde a través de la relación entre HCO3 y H2CO3, se establece el pH normal del plasma (1, 6, 22-24). Dado que el H2CO3 no se puede medir directamente, este se calcula a partir de la presión parcial de CO2 y el coeficiente de solubilidad (α), asumiendo una temperatura estable. En este orden de ideas la ecuación sería:
pH = 6.1 + log (HCO3) / 0.03 x pCO2
pH= 6.1+ log 24 / 0.03* 1.2
pH= 6.1 +1.3
pH= 7.4
Esto permite establecer el pH normal del plasma basado en la relación entre el bicarbonato (HCO3-) y la presión parcial de dióxido de carbono (pCO2). Esta relación, a su vez, refleja la capacidad del riñón para regular el HCO3- y del pulmón para regular la pCO2 en la fisiología normal.
En un individuo normal la pCO2 se mantiene entre 35-40 mmHg, la principal forma de eliminar el CO2 es por medio de la exhalación, por lo que cualquier alteración en la eliminación de este gas puede aumentar el pH en sangre. Como se había nombrado previamente la ventilación alveolar se controla por quimiorreceptores a nivel central, cuerpo carotídeo y arco aórtico. Una alteración en la concentración de H+ o pCO2 implica un cambio en la ventilación alveolar. Por ejemplo: Un aumento de los H+ más la disminución en el pH conlleva a la disminución de la ventilación alveolar y causa por lo tanto de forma compensatoria la eliminación de pCO2, llevando al pH a la normalidad. De forma contraria la disminución de los H+ con el consecuente aumento del pH llevará a un aumento de la ventilación alveolar y por lo tanto la eliminación de CO2 para lograr la homeostasis respectiva3,23,25.
De forma homologa, el riñón a través de tres mecanismos logra mantener un pH normal: reabsorción del HCO3 filtrado, eliminación de ácidos titulables y aumento en la excreción de amonio2,3,23.
Reabsorción del HCO3 filtrado: Aproximadamente se filtran al día alrededor de 4320 mEq de bicarbonato a través del glomérulo, pero solo se excretan 3 mEq en la orina, lo que indica que la mayor parte del bicarbonato filtrado es reabsorbido en los diferentes segmentos tubulares de la nefrona. El túbulo proximal es responsable de aproximadamente el 80% de la absorción, seguido del asa de Henle con un 10%, el túbulo distal con un 6% y el colector con un 4% (Figura 5)2,3,23.
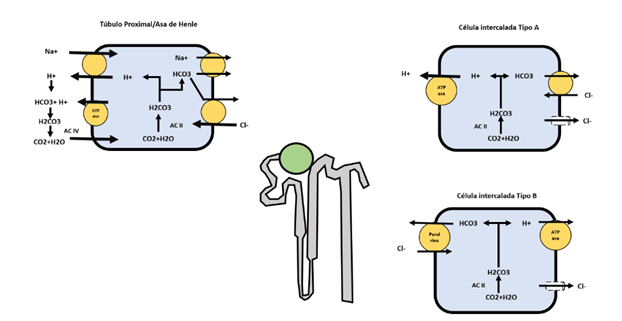
Fuente: Elaboración propia
Figura 5. Reabsorción del bicarbonato en el túbulo contorneado proximal y Asa de Henle. Célula Intercalada tipo A y Célula Intercalada tipo B. Esta gráfica fue diseñada por los autores del capítulo
Interpretación de trastorno ácido base
Acidosis Metabólica
Alteración producida por la disminución en los niveles plasmáticos del bicarbonato, la cual está causada por: alteraciones en la capacidad de eliminación de ácidos, mayor concentración de hidrogeniones y pérdida de bicarbonato por vía renal o gastrointestinal. El mecanismo compensatorio de este trastorno es la hiperventilación con el consecuente descenso del CO220-23.
Con el fin de establecer la causa de la acidosis metabólica existen múltiples estrategias para la cuales se deben tener claros algunos conceptos:
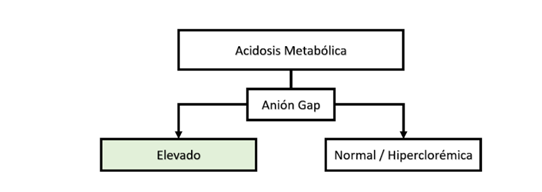
Anión Gap: Evalúa la diferencia entre la suma de aniones y cationes. El valor normal es de 12 mEq/L +/-2, lo cual representa la presencia de aniones no medibles, tanto orgánicos como inorgánicos.
Como principio general, es importante mantener la neutralidad eléctrica en el plasma, lo que implica una suma igual de cationes y aniones. Al observar el gamblegrama, se puede apreciar la composición química del plasma y cómo se logra un equilibrio armónico a pesar de los cambios en los diferentes componentes.
Basados en el concepto de la neutralidad eléctrica y el anión Gap se puede clasificar a la acidosis metabólica en dos: (figura 6).
En la Figura 7 se puede observar que en los dos tipos de acidosis metabólica hay una disminución del HCO3. Sin embargo, la diferencia radica en cómo se ocupa el espacio dejado por la disminución del HCO3. En la gráfica B, el espacio es ocupado por aniones no medibles, mientras que en la gráfica C, el espacio es ocupado por el ion cloro (Cl-). A esta primera situación se le conoce como acidosis metabólica con anión gap elevado, y a la segunda como acidosis metabólica hiperclorémica25-32.
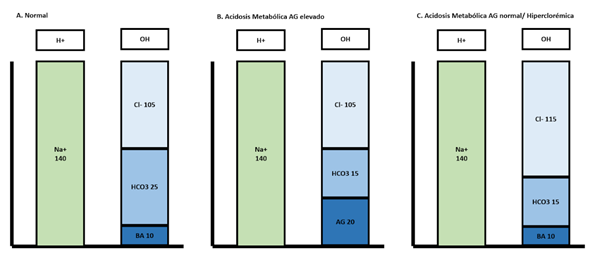
Fuente: Elaboración propia
Figura 7. Neutralidad eléctrica en la acidosis metabólica con anión gap elevado y con anión gap normal. En la acidosis metabólica se encuentra el bicarbonato disminuido, sin embargo, para mantener la neutralidad eléctrica, se elevan los aniones no medibles o el cloro
Una vez se establece, clasifica y determinan las posibles causas de acidosis metabólica, se debe definir si se trata de un trastorno mixto. En este caso, se debe abordar el algoritmo desde la parte que hace referencia a acidosis metabólica con anión gap elevado y comprender la siguiente afirmación: Si hay un anión no medido, previamente un ácido se disoció y liberó un hidrogenión, este H+ consume por lo tanto una unidad de bicarbonato25-32.
Posteriormente, al calcular la diferencia entre el anión gap del paciente con acidosis metabólica y el resto del anión gap normal, se podrá establecer cuantos aniones se adicionaron, para desencadenar la acidosis con anión gap elevado.
Delta del Anión gap = anión gap actual - anión gap normal
Delta de anión gap = anión gap actual - 10 o 12
Tras lograr el cálculo de aniones adicionales que tiene el paciente, se puede saber cuántos HCO3 fueron gastados (Relación 1:1 = por cada anión se gastó un HCO3). Comprendiendo lo anterior, el siguiente paso es sumar al HCO3 cada HCO3 gastado y así se podrá conocer el HCO3 previo esperado y a su vez se podrá determinar si el paciente cursa con un trastorno mixto. Veamos un ejemplo:
Paciente de 24 años con cetoacidosis diabética con pH 7.2, HCO3 12 mmHg CO2 40 mmHg anión gap 20.
Delta de anión gap = anión gap actual - anión gap normal
10 corresponde a los aniones adicionales que tiene el paciente y que lo condicionan al desarrollo de acidosis con anión gap elevado
HCO3 previo esperado = Delta de anión gap + HCO3 actual
Entendiendo que por cada anión adicional se gasta una unidad de HCO3, se procede a sumar esos HCO3 “gastados” al HCO3 actual del paciente, para así conocer cuál era el valor de HCO3 previo del paciente y determinar si antes de la acidosis metabólica con anión gap elevado ya había un trastorno instaurado.
Teniendo el HCO3 previo esperado tenemos por lo tanto 3 situaciones. Figura 8
HCO3 = a 24 mEq/L: No tenía ninguna alteración previa
HCO3 mayor de 24 mEq/L: Antes de la acidosis metabólica con anión gap elevado el paciente cursaba con alcalosis metabólica.
HCO3 menor de 24 mEq/L: Antes de la acidosis metabólica con anión gap elevado el paciente cursaba con una acidosis metabólica.
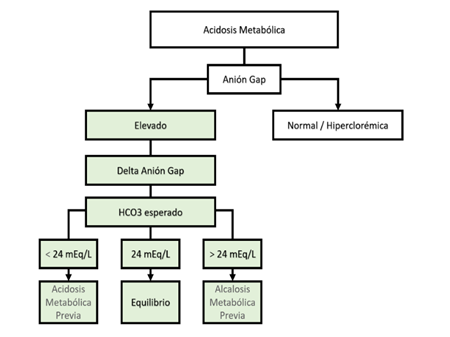
Fuente: Elaboración propia
Figura 8. Clasificación de la acidosis metabólica según el anión gap y el bicarbonato esperado
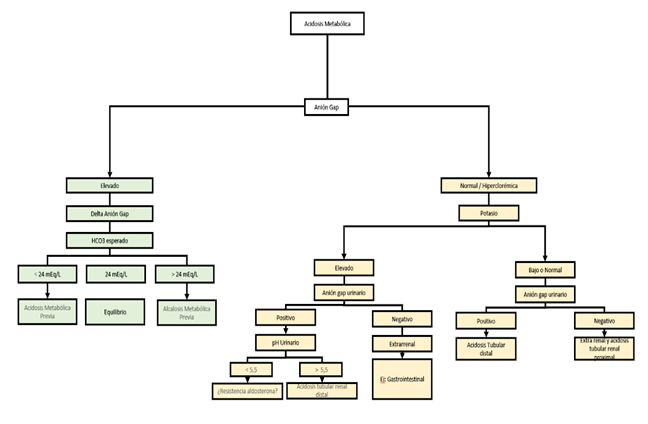
En una acidosis metabólica con anión gap normal o hiperclorémica, se debe evaluar el anión gap urinario para determinar la capacidad del riñón de eliminar amonio en el contexto de acidosis metabólica. En este caso, no se tiene en cuenta el HCO3 debido a la especificidad de los mecanismos contrarreguladores renales, que se enfocan en la absorción de HCO3 desde la luz del túbulo renal para intentar normalizar el pH. Sin embargo, cuando estos mecanismos se ven superados, se procede a acidificar la orina, lo cual implica la eliminación de amonio. Para calcular el anión gap urinario se utiliza la fórmula: (Na+ + K+) - (Cl-) (3). El valor normal de este anión gap urinario se encuentra entre 0 y -50 mEq/L. Un valor cercano a cero o positivo indicaría una incapacidad del riñón para acidificar la orina y, por lo tanto, una falta de compensación de la acidosis metabólica25-32.
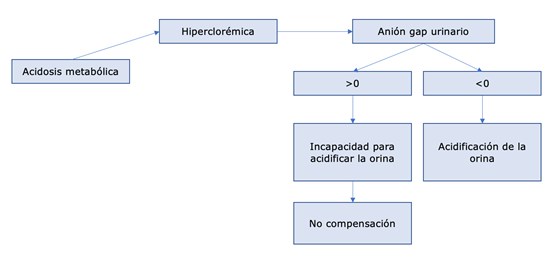
Figura 9. Evaluación de la Compensación de la Acidosis Metabólica Hiperclorémica mediante anión gap urinario
Finalmente, en el abordaje de acidosis metabólica con anión gap normal, se debe medir el potasio sérico para desglosar el algoritmo y determinar las posibles causas como lo muestra la Figura 10.
Acidosis Respiratoria
Los factores que determinan la homeostasis del CO2 incluyen la eliminación, el transporte, la producción y el control de la ventilación mecánica por el sistema nervioso central. La producción de CO2 se debe principalmente al metabolismo de los lípidos y carbohidratos, generando en promedio entre 10,000 y 15,000 mmol de CO2 al día. El ejercicio y cualquier proceso que aumente la demanda metabólica conducirá a un incremento en la producción de CO232-35.
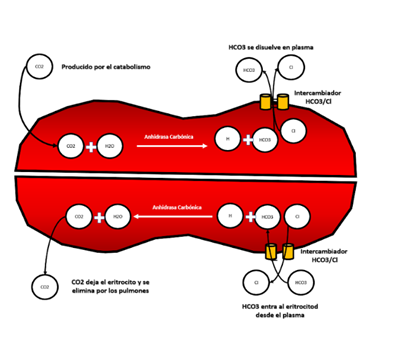
El transporte de CO2 ocurre a través de los glóbulos rojos y el plasma. En presencia de la anhidrasa carbónica, el CO2 se convierte en H2CO3 y posteriormente se disocia en H + y HCO3-. El HCO3- utiliza el intercambiador Cl-/HCO3- para difundir hacia el plasma. Este proceso también ocurre en sentido inverso, donde el HCO3- ingresa al eritrocito y se convierte en H2CO3. Luego, gracias a la anhidrasa carbónica, se forma una molécula de H2O y CO2, permitiendo que este último atraviese la membrana alveolocapilar y se elimine32-35.
La eliminación de CO2 se realiza principalmente mediante la ventilación alveolar, siendo un determinante clave. Sin embargo, factores como el flujo sanguíneo, la difusión del CO2 y el espacio muerto también influyen en el equilibrio normal de este gas32-35.
Finalmente, el sistema nervioso central, a través de quimiorreceptores ubicados en la médula, el intersticio y el líquido cefalorraquídeo, junto con los efectores que responden a los cambios detectados en el centro respiratorio de la médula, permiten mantener los niveles de CO2 dentro de la normalidad. Cualquier alteración en alguno de estos mecanismos puede resultaren acidosis respiratoria32-35. Figura 11
Cuando encontramos valores de pH disminuidos y pCO2 mayores a 35-40 mmHg, decimos que estamos frente a una acidosis respiratoria. Los mecanismos renales y extrarrenales evitan la pérdida de HCO3- con el fin de impedir una disminución constante del pH32-35.
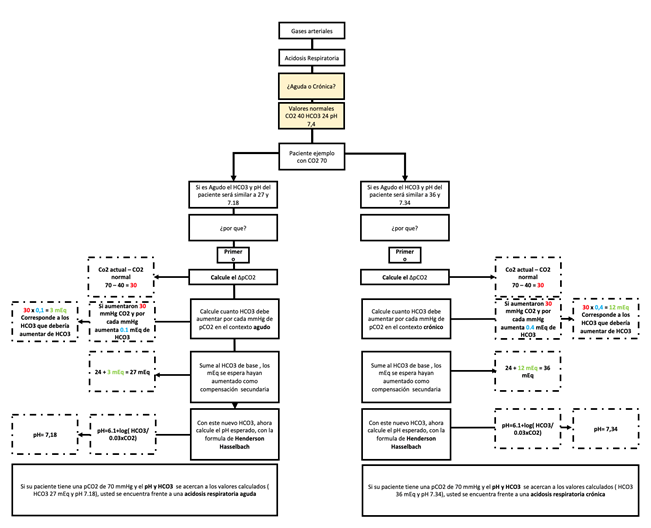
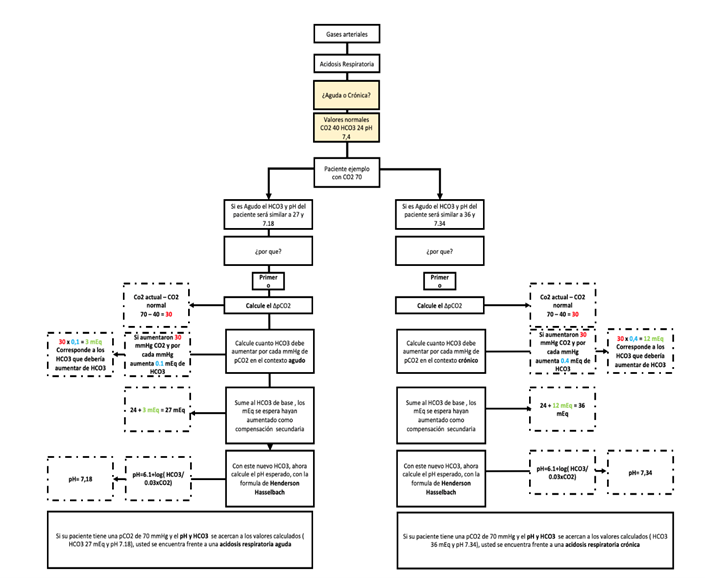
Al enfrentarnos a un paciente con acidosis respiratoria, debemos establecer las posibles causas de este trastorno y determinar si se trata de un proceso agudo o crónico. Para ello, debemos tener en cuenta el siguiente concepto:
Acidosis respiratoria aguda: por cada mmHg de aumento en la pCO2, el HCO3- aumenta en 0.1 mEq/L.
Acidosis respiratoria crónica: por cada mmHg de aumento en la pCO2, el HCO3- aumenta en 0.4 mEq/L.
Basándonos en el concepto de compensación, podemos comprender el enfoque del abordaje de un paciente con acidosis respiratoria utilizando el algoritmo presentado en la Figura 12.
Alcalosis Metabólica
La alcalosis metabólica es una alteración ácido-base caracterizada por un aumento en la concentración de bicarbonato plasmático y una disminución en los hidrogeniones. Se establece cuando los gases arteriales muestran un pH mayor de 7.45, con elevación del bicarbonato y dióxido de carbono. Esta condición suele inducir hipoventilación, lo que resulta en un aumento del dióxido de carbono. Sin embargo, esto a su vez predispone a una disminución de la PaO2, convirtiéndose en un mecanismo fisiológicamente costoso que el cuerpo no puede mantener36-45.
La alcalosis metabólica está asociada principalmente a la terapia con diuréticos, pérdidas de secreciones gástricas y procedimientos quirúrgicos. Tabla 2
Tabla 2. Causas de alcalosis metabólica.
| Sensible <br> | Resistente <br> |
|---|---|
| (Sodio urinario < 20 mEq/L, Cloro urinario < 20 mEq/L) | (Sodio urinario > 20 mEq/L, Cloro urinario > 20 mEq/L) |
| Tracto Gastrointestinal | Exceso de mineralocorticoides |
| - Emesis | - Aldosteronismo primario |
| - Succión gástrica | - Síndrome de Cushing |
| Renal | - Tumores secretores de renina |
| - Diurético de asa | Misceláneas |
| - Tiazidas | - Síndrome de Bartter |
| - Aniones pobremente reabsorbidos | - Depleción severa de potasio |
| Administracion de álcalis | - Antiácidos no absorbibles |
| Drogas | |
| - Derivados del cortisol |
Fuente. Elaboración propia
Existen varios factores responsables del aumento de los niveles de bicarbonato renal en la alcalosis metabólica, y algunos de ellos son los siguientes:
Reducción del volumen del líquido extracelular: En condiciones en las que hay una disminución del volumen sanguíneo (causado por diuréticos, vómitos o sonda nasogástrica), se activa como mecanismo compensatorio el sistema renina-angiotensina-aldosterona. Este sistema tiene como objetivo reabsorber sodio, agua y bicarbonato en el túbulo contorneado proximal. Para lograr esto, se activa la bomba de Na/K ATPasa, que absorbe sodio a través de la activación del intercambiador Na +/H+ en la luz del túbulo proximal. Posteriormente, los iones de HCO3- formados intracelularmente, junto con el sodio, se mueven hacia el capilar a través del cotransportador Na/3HCO3-, lo que permite recuperar aproximadamente el 90% del bicarbonato filtrado36-45. Figura 13
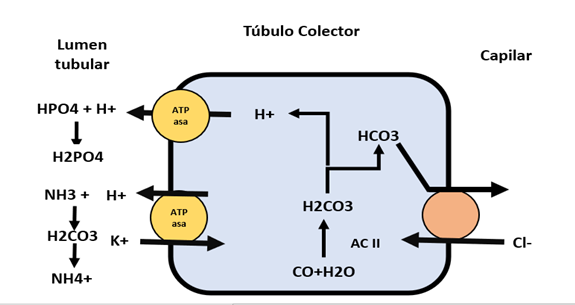
Adicionalmente, en el túbulo colector, se produce intracelularmente la conversión del ácido carbónico a bicarbonato y iones hidrógeno mediante la enzima Anhidrasa Carbónica (AC II). Los iones hidrógeno son eliminados a través del túbulo mediante la bomba H +/ATPasa, mientras que el bicarbonato es reabsorbido hacia el capilar mediante un intercambiador Cl-/HCO3-. Esto permite la reabsorción del 90% del bicarbonato filtrado, mientras que el 10% restante es eliminado. Algunas de las patologías relacionadas con este mecanismo incluyen la insuficiencia cardíaca y la cirrosis36-45. Figura 14
Hipocloremia: Este mecanismo es similar al de la depleción de volumen, ya que existe una estrecha relación entre los niveles de cloro y el estado de volumen del paciente. La hipocloremia puede presentarse en pacientes quirúrgicos debido a la succión gástrica, vómitos persistentes o en aquellos con obstrucción pilórica que impide la eliminación de jugos gástricos alcalinos. Es importante medir los niveles de cloro en la orina para diferenciar entre alcalosis metabólica sensible o resistente al cloro36-45.
Alcalosis metabólica sensible al cloro: Se considera cuando los niveles de cloro en la orina son inferiores a 20 mEq/L. En este caso, ante la pérdida de cloro, el principio de electroneutralidad busca mantener el equilibrio iónico negativo mediante la reabsorción o reducción de la excreción de otro ion negativo, como el bicarbonato. Esto resulta en un aumento de los niveles séricos de bicarbonato, lo que conduce a la alcalosis metabólica36-45.
Alcalosis metabólica resistente al cloro: Se considera cuando los niveles de cloro en la orina son superiores a 20 mEq/L. Esta situación nos permite descartar la depleción de cloro como un defecto primario y establecer posibles causas, como el exceso de mineralocorticoides, cortisol y patologías en las que hay una eliminación aumentada de potasio y cloro. En estos casos, la corrección de la hidratación del paciente no resuelve la alcalosis metabólica36-45.
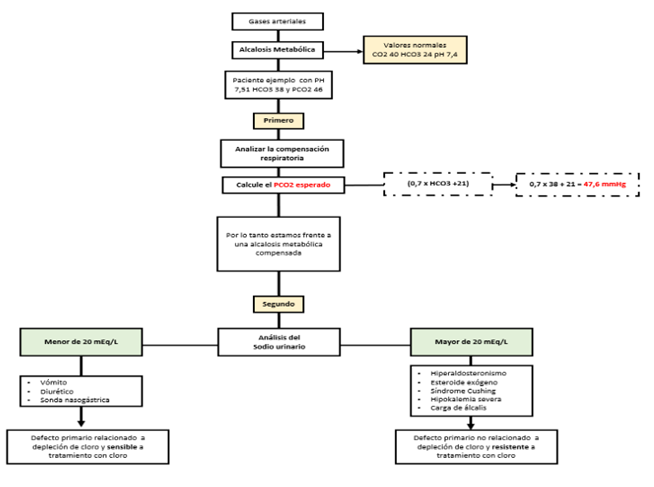
Al enfrentarse a un paciente con alcalosis metabólica (Figura 15), se deben tener en cuenta diversas consideraciones. En primer lugar, es importante verificar si los resultados de los gases arteriales son consistentes, comparando la PCO2 reportada con la PCO2 esperada. Luego, se evaluarán los niveles de cloro en la orina para determinar si la alcalosis metabólica está relacionada con una depleción de cloro como defecto primario o no. Por último, se buscarán los valores compensatorios que indiquen la presencia de una alteración coexistente. Se debe tener en cuenta que, por cada mEq de incremento en el bicarbonato, la PaCO2 aumenta entre 0.5 y 1.0 mmHg36-45.
Alcalosis Respiratoria
Se trata de un trastorno ácido-base que se produce como resultado de una disminución en los niveles plasmáticos de dióxido de carbono (PaCO2) (2). Algunos casos pueden estar asociados con insuficiencia hepática, síndrome de ansiedad, embolia pulmonar, edema pulmonar y, principalmente, con la ventilación mecánica utilizada para corregir la hipoxemia. Estas alteraciones se pueden clasificar en agudas o crónicas, según el momento en que se presente el defecto primario, y también en función de la comparación entre el gradiente de pH esperado y el calculado36,46-50.
Alcalosis respiratoria aguda
Se presenta dentro de las primeras 24 - 48 horas
El gradiente de Ph esperado es igual al calculado por la fórmula 0,75 × Delta PCO2 / 100, donde el delta de PCO2 = PCO2 actual - 40
Generalmente se observa una rápida disminución de la PaCO2 con un aumento del pH y niveles normales de bicarbonato, debido a que el mecanismo de compensación renal es lento. Los mecanismos de amortiguación celular que se producen en respuesta a la hipocapnia aguda se generan a través de un intercambio iónico celular que implica:
La liberación de iones de hidrógeno desde el interior hacia el exterior de la célula.
La entrada celular de iones de bicarbonato, sodio, potasio y cloro.
De esta manera, el principal riesgo asociado con la alcalosis severa es la deficiencia de potasio en el intercambio iónico, lo que conlleva un riesgo inherente de arritmias, como la fibrilación ventricular, y convulsiones36,46-50.
Alcalosis respiratoria crónica
Se presenta posterior a 48 horas
El gradiente de pH esperado es igual al calculado por la fórmula 0.25 × Delta PCO2 / 100 donde el delta de PCO2 = PCO2 actual - 40
En los casos de hipocapnia crónica, los mecanismos de amortiguación "buffers" se agotan y el riñón se hace responsable del cambio de las concentraciones de bicarbonato séricas.
Al enfrentarse a un paciente con alcalosis respiratoria figura 16, es importante primero confirmar la precisión de la PCO2 informada en comparación con la PCO2 esperada. Posteriormente, se debe calcular el gradiente de pH esperado para el gradiente de PCO2, con el fin de clasificar el trastorno como agudo o crónico. Además, es necesario buscar los valores de compensación que determinen la presencia de una alteración coexistente. Cabe destacar que por cada disminución de un milímetro de mercurio en la PaCO2 por debajo de 40 mmHg, se produce un aumento de un punto en el segundo decimal del valor del pH por encima de 7.436,46-50.