INTRODUCCIÓN
El cáncer de tiroides es una enfermedad cada vez más frecuente e incluso ha incrementado 167% en las últimas 3 décadas1. Según estimaciones de GLOBOCAN para el año 2020 hubo alrededor de 586.000 casos nuevos y 43.500 muertes en el mundo, ocupando el noveno lugar de mayor incidencia. En mujeres la tasa de incidencia estandarizada por edad fue de 10.1 por 100.000, mientras que para los hombres fue de 3.1 por 100.000; siendo Asia el continente con mayor incidencia, prevalencia y mortalidad, el cual representa alrededor del 60% de las cifras2. Para América Latina se reportó un incremento de nuevos casos del 400% entre 1990 y 2019.
El cáncer de tiroides corresponde a una neoplasia que se origina en el epitelio folicular de la tiroides o en las células epiteliales parafoliculares3. Según la nueva clasificación de la OMS 2022 las neoplasias de tiroides malignas se clasifican en tumores diferenciados: carcinoma folicular tiroideo, carcinoma oncocítico de tiroides, carcinoma tiroideo papilar variante folicular encapsulada invasiva, carcinoma papilar de tiroides y carcinoma tiroideo de alto grado diferenciado. Los no diferenciados son: pobremente diferenciado y anaplásico. En esta guía no nos referiremos a los no diferenciados.
El 90% de los casos corresponden al tipo cáncer diferenciado de tiroides (CDT), en su mayor parte papilar y sus variantes en aproximadamente el 80-90%4, y folicular el 10-15% con una supervivencia general a 10 años de 93% y 85%, respectivamente5,6.
Tradicionalmente el manejo para el CDT ha consistido en cirugía añadiendo en muchos casos terapia con iodo, cuya decisión se basa en la estratificación del riesgo a partir de algunas características de la enfermedad, realizada por única vez al momento del diagnóstico7. Si bien el manejo quirúrgico es un pilar importante del tratamiento, se ha reportado la sobre realización de procedimientos con resultados citológicos no confirmatorios en al menos el 70% de los casos8,9, además, del riesgo innato de la cirugía, las complicaciones, afectación de calidad de vida de los pacientes y los costos de la atención9. Por lo que, en la última década, ha tomado mayor relevancia la estratificación del riesgo, analizada desde el momento de sospecha de la enfermedad hasta el seguimiento y también la introducción de la decisión de vigilancia activa como alternativa a un procedimiento quirúrgico inmediato según un análisis crítico7, adaptable en función del cambio del riesgo del paciente. Además, la vigilancia activa podría conllevar a 4 veces menos costos en salud10,11. Aunque existe acuerdo entre los especialistas que tratan los pacientes con CDT, la vigilancia activa no corresponde a una práctica estandarizada en Paraguay y seguramente tampoco en otros contextos, debido a resistencia de pacientes, médicos e inconsistencia en la evidencia10, razón por la cual se emprendió el desarrollo de la presente guía.
Si bien, el Registro de Cáncer de Base Poblacional (RCBP) fue creado mediante la Resolución Ministerial N˚ 97/2017, ha sido implementado efectivamente desde el año 2019 y ha iniciado la recolección de primeros datos en julio del 2020, bajo el liderazgo de la Dirección de Enfermedades No Transmisibles dependiente de la Dirección General de Vigilancia de la Salud del Ministerio de Salud Pública y Bienestar Social (MSPBS). Por lo tanto, para la elaboración de esta guía, no hemos contado con datos estadísticos nacionales del cáncer de tiroides.
Además de destacar la importancia de adaptarla a Paraguay y específicamente a la institución, con las características clínicas y sociales de la población, aportamos nuestra experiencia a través de datos del Servicio de Endocrinología. De junio a setiembre, 2022, en el Servicio de Endocrinología, se ha registrado un total de 103 pacientes con CDT, con una media de edad de 49 años, correspondiendo el 86% al sexo femenino, un 85% a CDT de tipo papilar. Si bien, no todos corresponden a nuevos casos diagnosticados, se demuestra la alta carga asistencial del servicio y el trabajo multidisciplinario.
DEFINICIÓN DEL ALCANCE
Objetivo: Generar recomendaciones basadas en evidencia sobre el tratamiento y seguimiento de personas adultas con cáncer diferenciado de tiroides.
Alcance: Tratamiento y seguimiento de personas adultas con sospecha o confirmación de cáncer diferenciado de tiroides.
Población: Personas adultas (>18 años) con sospecha o confirmación de cáncer diferenciado de tiroides.
Población excluida: Gestantes.
Aspecto: Consulta ambulatoria.
Usuarios: Médicos especialistas en endocrinología y demás profesionales involucrados en la atención de pacientes con sospecha o diagnóstico de cáncer diferenciado de tiroides.
METODOLOGÍA
Una guía de práctica clínica se desarrolló para 4 preguntas de interés clínico. 1. ¿Cuáles son las indicaciones de la vigilancia activa?, ¿cómo realizarla?, ¿cuándo y con qué periodicidad realizarla? 2. ¿Cuál es el tratamiento y su indicación en pacientes con nódulos tiroideos sospechosos de cáncer? 3. ¿Cómo y cuándo realizar seguimiento de pacientes con CDT de acuerdo con el riesgo dinámico? 4. ¿Cuál es el manejo actual de los pacientes iodo refractarios?
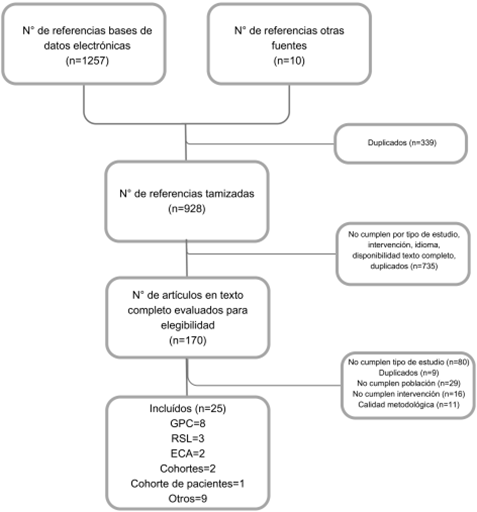
Se realizó una búsqueda estructurada de guías de práctica clínica en sitios oficiales de grupos desarrolladores o compiladores de guías, además, se realizaron búsquedas complementarias para actualizar la evidencia extraída de las GPC, a través de RSL con y sin metaanálisis, estudios primarios tipo ensayos clínicos y estudios observacionales. La búsqueda se realizó en las bases de datos bibliográficos Medline vía PubMed y en Embase y estuvo restringida a los últimos 10 años y publicaciones en español e inglés.
Los resultados de la búsqueda fueron revisados de manera pareada por un experto clínico y un epidemiólogo, evaluando 3 criterios, (i) consistencia entre el alcance y objetivos de la guía encontrada y la propuesta por este grupo; (ii) reporte de metodología o proceso de desarrollo y (iii) formulación y gradación de recomendaciones. Para los documentos que resultaron de la búsqueda de evidencia se realizó tamización por título y resumen de manera pareada e independiente por experto clínico y metodológico, posteriormente se evaluaron a texto completo para verificar la pertinencia del documento y su inclusión para soportar las recomendaciones (Anexo 1).
Algunos documentos fueron incluidos por preferencia de los especialistas: European Thyroid Association Guidelines for the Treatment and Follow-Up of Advanced Radioiodine-Refractory Thyroid Cancer4, Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up12, European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS13, European Thyroid Association and Cardiovascular and Interventional Radiological Society of Europe 2021 Clinical Practice Guideline for the Use of Minimally Invasive Treatments in Malignant Thyroid Lesions14, The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging15, 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? (16 y ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee17.
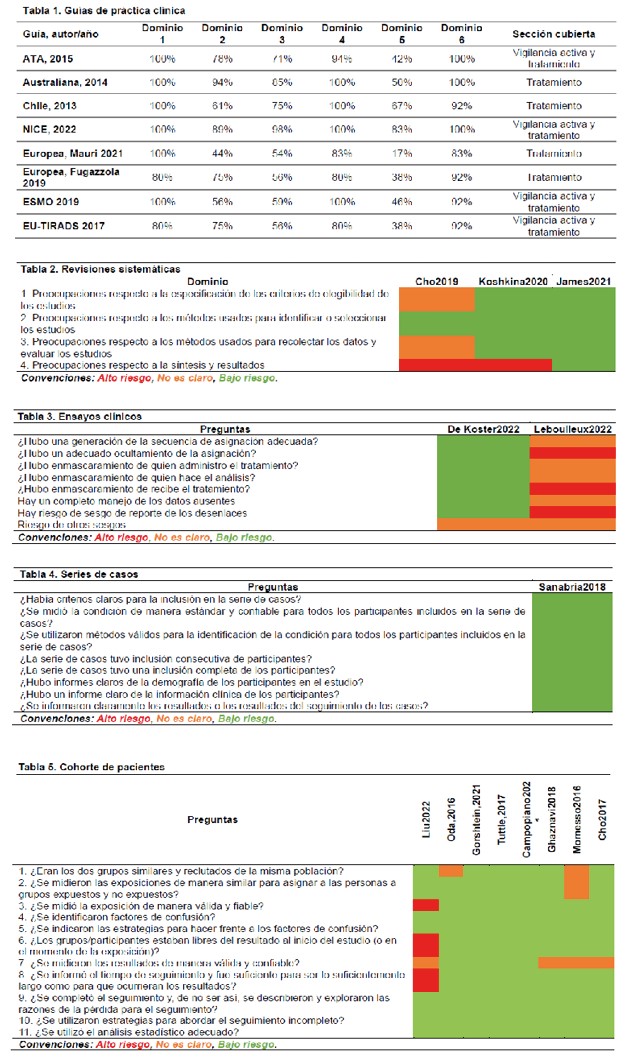
La calidad de la evidencia de las GPC fue calificada con AGREE II, las RSL con ROBIS, los ensayos clínicos con la herramienta de riesgo de sesgo de Cochrane-RoB y los estudios observacionales con los instrumentos de Joanna Briggs (Anexo 2).
Las recomendaciones fueron construidas a partir del análisis crítico sobre vigencia y factibilidad de la implementación en el contexto paraguayo de las recomendaciones extraídas de las guías encontradas en la literatura y complementadas con los resultados de las búsquedas adicionales. La gradación se basó en la calidad de la evidencia, el análisis de riesgo-beneficio, acceso y disponibilidad de las intervenciones en el contexto de interés y la experticia clínica de acuerdo con la intensidad en fuerte o condicional y por sentido en favor o en contra18. Fuerte a favor : Los expertos clínicos basados en la evidencia y su experticia consideran que la práctica o conducta promovida en la recomendación favorece a la gran mayoría o a todos los pacientes y desde su juicio debe ser implementada en la práctica cotidiana; Débil a favor : Los pacientes podrían beneficiarse de la práctica promovida en la recomendación, aunque se requieren algunas condiciones del paciente, contexto o nueva evidencia que respalde los resultados. Para las categorías Fuerte en contra o débil en contra , la práctica de la recomendación es desaconsejada porque podría implicar mayor riesgo que beneficio al paciente o la evidencia no es concluyente. En ausencia de evidencia para soportar las recomendaciones o sugerencias no se realizó graduación y se especifica como opinión de experto.
Como mencionamos anteriormente en el presente artículo, nos enfocaremos en vigilancia activa (VA) y las recomendaciones correspondientes.
VIGILANCIA ACTIVA
La vigilancia activa corresponde al proceso dinámico y activo de seguimiento del paciente con sospecha o diagnóstico citológico de cáncer diferenciado de tiroides menor a 1 cm, que se presenta como alternativa segura y efectiva al manejo quirúrgico inmediato en pacientes específicos19. Se realiza con el fin de orientar el manejo idóneo y pertinente a partir del análisis integral del riesgo de mortalidad, la recurrencia, la predicción de la respuesta al tratamiento e incluso la remisión de la enfermedad7,20.
En el estudio observacional de Oda y cols., 201611 se comparó la incidencia de eventos adversos relacionados con la vigilancia activa y la cirugía inmediata realizadas por especialistas del centro de excelencia en cuidado de tiroides en 2153 pacientes con micro carcinoma papilar de bajo riesgo durante seguimiento de 47 meses (RIQ 12 a 116 meses). La vigilancia se realizó con ecografía y pruebas de función tiroidea a los 6 meses del diagnóstico y posteriormente de frecuencia anual. Para el grupo expuesto a cirugía (hemitiroidectomía y disección paratraqueal o tiroidectomía total con disección del compartimento central del cuello), esta se llevó a cabo dentro de 11 meses posteriores al diagnóstico y después de la cirugía se realizó seguimiento con ecografía, función tiroidea y paratiroidea.
De los pacientes en vigilancia activa, en el 2,3% se encontró crecimiento tumoral, en el 0,5% metástasis en ganglios linfáticos y en el 8% se convirtieron a cirugía por cambio de preferencia del paciente, uno de ellos presentó recidiva en el compartimento lateral del cuello, tratada exitosamente con disección. En el grupo de cirugía inmediata, el 0,5% presentó recurrencia por lo que requirieron tiroidectomía total. El 4,1% presentó parálisis de cuerdas vocales, una incidencia mayor respecto al grupo de vigilancia activa (p<0,05). La parálisis de cuerdas vocales (PCV) permanente sólo se produjo en dos pacientes (0,2%) de este grupo. También hubo mayor incidencia de hipoparatiroidismo temporal (16,7% versus 2,8%, p<0,05) y de hipotiroidismo permanente (1,6% versus 0,08%, p<0,05). No hubo casos de metástasis a distancia en ningún grupo. Hallazgos semejantes fueron reportados en el estudio de Miyauchi, 201521, que documenta la experiencia de 30 años desde 1993 para la comparación de vigilancia activa y cirugía y como resultado se sugirió que ambas alternativas de manejo eran buenas para el paciente, sin embargo, se encontró menor incidencia de eventos adversos relacionados con la vigilancia activa, aunque es clara la necesidad de realizar una identificación adecuada de los candidatos para minimizar el riesgo de este tipo de eventos y mejores desenlaces clínicos para los pacientes. A continuación, se presentan las indicaciones de la vigilancia activa, estudios de seguimiento y periodicidad.
¿Cuáles son las indicaciones de la vigilancia activa?
La vigilancia activa tiene su inicio en el momento de la identificación del nódulo tiroideo menor a 1 cm, con características ecográficas sospechosas de malignidad (hipoecogenicidad marcada, microcalcificaciones, márgenes irregulares y más alto que ancho: TIRADS 5/ATA alta sospecha) o con citología Bethesda V o VI, tiempo a partir del cual se analizan las características de los pacientes por si cumple criterios para ser un buen candidato a vigilancia activa. Estas características se resumen en pacientes mayores de 60 años, sin evidencia de extensión extracapsular o metástasis en los ganglios linfáticos12, que comprendan el procedimiento y se comprometan al seguimiento, siempre teniendo en cuenta las preferencias del paciente13,19,20. En estos pacientes bajo vigilancia es posible hacer un seguimiento activo y diferir la cirugía si fuese necesario, al momento que se observe ciertos criterios clínicos y ecográficos.
Sin embargo, aún no es una práctica instaurada para la atención de pacientes con sospecha o diagnóstico de CDT debido a limitaciones en la evidencia que permitan generalizar los hallazgos. A continuación, se describen algunos estudios que han evaluado la vigilancia activa como alternativa de manejo en pacientes con CDT.
En la revisión sistemática de Cho y cols en 2019, se evaluó el crecimiento tumoral y la metástasis de ganglios linfáticos en pacientes con micro carcinoma papilar de bajo riesgo y en pacientes Bethesda V y VI en un periodo de seguimiento de 5 años. A partir de 3 estudios meta-analizados, se reportó una tasa de crecimiento a los 5 años de 5,3% (IC95%, 4,4-6,4%), que aumenta gradualmente durante cada año de seguimiento. Respecto a la metástasis de ganglios linfáticos al cabo del quinto año de seguimiento hubo una tasa de 1,5% (IC95%, 1,1-2,4%)10.
En Latinoamérica, la experiencia reportada de un centro colombiano incluyó 57 pacientes con nódulos tiroideos Bethesda V a VI. La vigilancia activa se realizó a quienes tenían micro carcinoma de bajo riesgo definido por diámetro inferior a 1,5 cm, encapsulado, sin evidencia de metástasis en los ganglios linfáticos y con conversión a cirugía en casos de enfermedad sintomática, crecimiento del tumor o por preferencia del paciente. El 16% de los nódulos fueron clasificados según ATA como de bajo riesgo y el 61% fueron Bethesda V. El 28% de los casos hubo crecimiento tumoral menor a 3 mm, solo dos casos superaron este umbral. Al 9% de los pacientes se realizó cirugía. Todos presentaban un carcinoma papilar tratado mediante lobectomía. La tasa de estabilidad general sin cirugía fue del 92,5% a los 12 meses24.
Respecto a la asociación de la edad y la progresión del carcinoma papilar de tiroides de bajo riesgo, en pacientes en vigilancia activa, el metaanálisis de Koshkina y cols., 202025 agrupó 1619 pacientes para quienes se encontró un 50% menos riesgo de crecimiento tumoral >3 mm en el diámetro en aquellos con edad de 40 a 50 años respecto a pacientes más jóvenes (RR=0,51, IC95%, 0.29-0.89). Para metástasis ganglionares se estimó un riesgo 80% menor en pacientes mayores de 40 años (RR=0,22, IC95 %, 0,10-0,47) (25.
Específicamente en la cohorte prospectiva analizada por Tuttle, 201726 de pacientes con sospecha de cáncer de tiroides <1,5 mm, por PAAF o por características ecográficas (hipoecoicos con márgenes irregulares, microcalcificaciones o forma más alta que ancha), sin extensión extra tiroidea, invasión de estructuras locales ni metástasis a distancia, eutiroideos, sometidos a vigilancia activa durante mínimo 6 meses con seguimiento ultrasonográfico semestral durante 2 años y anual a partir de ese momento. Los desenlaces de interés fueron crecimiento tumoral (>50% volumen o >3 mm de diámetro) y factores asociados al crecimiento. En el periodo de 25 meses (RIQ 6-166 meses) se clasificaron por pertinencia para vigilancia activa en: ideales (4,5%) si eran mayores de 60 años, micro carcinoma papilar solitario dentro de una glándula tiroides normal; apropiados (93,8%) aquellos menores de 60 años, con presencia de otros nódulos de apariencia benigna o características ecográficas de tiroiditis, o la proximidad cercana a la cápsula tiroidea (≤2 mm de tejido tiroideo normal entre el nódulo y la cápsula tiroidea). El restante (1,7%) no fueron apropiados definidos por características ecográficas sospechosas de extensión extra tiroidea menor o ganglios linfáticos subcentimétricos sospechosos adyacentes a la tiroides en el cuello central o lateral. El 1,7% de los pacientes recibieron cirugía debido a crecimiento tumoral a los 12 y 18 meses del seguimiento. El 1,7% cambio de preferencia. No hubo incidencia de metástasis durante el seguimiento. Se reportó una incidencia acumulada de crecimiento >3 mm del 2,5% a los 2 años y del 12,1% a los 5 años. Por cambio de volumen, la incidencia acumulada fue del 11,5% a los 2 años y del 24,8% a los 5 años. Todos los cambios de diámetro mostraron cambio de volumen, con una mediana de tiempo de duplicación de 2.2 años. La edad más joven (HR por año, 0.92; IC95 %, 0.87-0.98) la categoría de riesgo inapropiado, (HR: 55,17, IC95%, 9,40-323,19 p<0.001) se asociaron con el crecimiento de diámetro. El riesgo de crecimiento tumoral fue mayor 5 veces en pacientes menores de 50 años (HR: 4,5, IC95% 1,2-17,0) en referencia a los mayores de esta edad.
De manera complementaria, en una cohorte China22, se evaluó el estado psicológico y progresión de la enfermedad de 336 pacientes con nódulos tiroideos altamente sospechosos de cáncer de tiroides (<10 mm sin factores de alto riesgo como invasión extra tiroidea, metástasis linfática, proximidad a nervio laríngeo, tráquea o esófago) sometidos a vigilancia activa sin cirugía, a través de los cuestionarios semestrales de Escala de Ansiedad y Depresión Hospitalaria (HADS por siglas en inglés) y el Cuestionario de la Organización Europea para la Investigación y Tratamiento del Cáncer (EORTC, por siglas en inglés) en el Cuestionario Central de Calidad de Vida (EORTC QLQ-C30). En una mediana de seguimiento de 28.5 meses (RIQ 25 a 66 meses), se realizó a los pacientes examen físico, cuestionarios de estado psicológico y ecografía de cuello de manera semestral, así como seguimiento bioquímico de tiroglobulina (Tg) en suero, Tg-Ab, y TC tórax cada año. El 7,1% de los pacientes requirieron cirugía (n=24; 17 lobectomía con disección central de cuello; 7 tiroidectomía completa con disección central de cuello), de estos 15 se debieron a cambios en la preferencia del paciente y 9 tuvieron progresión de la enfermedad (crecimiento del tumor >3 mm respecto a la medición basal o desde la confirmación de malignidad, incidencia de metástasis en ganglio linfático o a distancia, invasión de nervio laríngeo recurrente, tráquea o esófago), los demás pacientes (n=308) permanecieron en vigilancia activa o se retiraron del estudio (n=4). Respecto al objetivo principal del estudio el promedio de puntuación en la escala HADS fue 4,0+3,3 (Sin problemas de relevancia clínica) y el 14,3% de los pacientes obtuvieron una puntuación >8 (Requerimiento de mayor estudio psiquiátrico o posibles casos). No hubo diferencias en las puntuaciones entre pacientes que permanecieron en vigilancia activa y quienes cambiaron de preferencia (cirugía) (p=0,415), tampoco con la escala EORT QLQ-C30. La incidencia acumulada de progresión de la enfermedad a los 5 años de seguimiento fue de 6% y a los 10 años fue de 12,8%, mientras que para los pacientes con cambio de preferencia fue de 8,2%. No hubo diferencias en progresión de la enfermedad en subgrupos de edad, sexo o tamaño del tumor. Para pacientes con cambio de preferencia de manejo, las puntuaciones en las escalas HADS fue mayor en pacientes menores de 30 años (p=0,033) y también tuvieron peor función emocional (p=0,013) respecto a mayores de 30 años, sin embargo, los resultados no se mantuvieron al ajustar por HADS inicial. La conclusión de los autores sugiere que la vigilancia activa es segura y factible en pacientes con nódulos de alta sospecha y podría requerir la participación de psicología para seguimiento del estado psicológico de los pacientes22.
¿Cómo realizarla?
Los autores coinciden en reforzar la necesidad de informar a los pacientes de forma clara y completa sobre el riesgo individual del CDT, el proceso diagnóstico, y las limitaciones asociadas a las pruebas diagnósticas (4,D) por lo tanto, durante la vigilancia activa los pacientes deben ser informados sobre el proceso, los estudios requeridos para seguimiento, la utilidad de estos, la necesidad de reemplazo de hormona tiroidea y vías para contactar a profesionales en caso de que se requiera20.
Respecto al seguimiento, se realiza fundamentalmente con la ecografía tiroidea, con valoración de ganglios linfáticos y citología por aspiración con aguja fina19 en los casos que sea necesario, siendo necesario que los pacientes estén informados sobre el motivo de los estudios27. También se ha reportado en estudios la realización de vigilancia activa a través de TC de tórax10.
La ecografía de tiroides y ganglios linfáticos se ha recomendado para todos los pacientes con nódulos tiroideos diagnosticados o sospechosos (Recomendación fuerte, evidencia alta calidad)19 o microcarcinomas papilares unifocales menores a 1 cm, sin evidencia de extensión extracapsular o metástasis en los ganglios linfáticos, con frecuencia de seguimiento semestral o anual (III, B) (12. Hay acuerdo en la necesidad de un reporte estructurado y estandarizado de la ecografía de tiroides que incluya la técnica de realización (declarando el dispositivo o ecógrafo empleado), antecedentes familiares y personales, como familiares con cáncer de tiroides, irradiación o cirugía de cuello o tiroides durante la infancia, resultados previos de aspiración con aguja fina. En el reporte se esperaría encontrar el volumen, ecogenicidad y vascularización de la glándula tiroidea. Para los nódulos, características de éstos como ubicación, tamaño (3 diámetros, volumen), forma, márgenes, ecogenicidad, composición, número de nódulos, cambios de tamaño, extensión extra tiroidea, desviación de la tráquea, estudio de los ganglios linfáticos y del ducto tirogloso. Al final, el reporte debería contener los hallazgos principales y en lo posible de manera comparativa con estudios previos, categorización o estadificación de los nódulos13 con algún sistema de reporte estandarizado. Cabe destacar que el crecimiento de los nódulos por sí solo no puede discriminar con precisión entre lesiones benignas y malignas, por lo que no se justifica la evaluación rutinaria del crecimiento de nódulos mediante ecografías seriadas con el fin de predecir cáncer13.
En una cohorte italiana28 de 109 pacientes con cáncer de tiroides papilar seguida por al menos 2 años a través de ecografía de cuello, se encontró que el 4,5% de los casos experimentaron progresión de la enfermedad posterior a 18 meses de seguimiento, en tres de los pacientes el volumen del nódulo creció más de 3 mm en 6 meses y otros tres pacientes presentaron metástasis en ganglio linfático. A partir del volumen estimado del nódulo con cáncer se encontró que el 20% tuvo aumento de volumen al menos en el 50% respecto a la estimación basal. Los autores sugieren que, ante cambios de volumen, la vigilancia activa debería suspenderse tan pronto como sea posible para evitar peores desenlaces en los pacientes28.
En nuestro hospital establecimos un formato de ecografía indispensable para poder realizar un seguimiento correcto, de modo a que todos los ecografistas tengan el mismo formato, con datos esenciales para realizar vigilancia activa. Entre las características importantes a reportar son la relación del nódulo con la tráquea y el ángulo que forma con ésta, pues un ángulo obtuso en la imagen ecográfica indica alto riesgo de invasión y no sería apto para vigilancia activa. Asimismo, es importante reportar la relación del nódulo con la capsula tiroidea y el nervio laríngeo recurrente, y que la proximidad con ambas estructuras indica riesgo de invasión, y de la misma manera no es apto para vigilancia activa.
En la ecografía también deben ser reportada la presencia de ganglios cervicales y sus características morfológicas, como forma, eco estructura, hilio y vascularización, de modo a determinar riesgo de malignidad. La presencia de ganglios sospechosos de malignidad ecográfica o citológicamente descalifica la vigilancia activa como alternativa.
Recientemente se ha valorado la utilidad de evaluación de la captación de 18-fluorodesoxiglucosa focal evidenciada en tomografía por emisión de positrones del 18 F-FDG-PET/CT en los micro carcinomas para predecir metástasis ganglionar en compartimiento central9, la cual se ha considerado como una prueba confiable con una sensibilidad de 68% y especificidad de 71% para nódulos tiroideos malignos. El estudio fue retrospectivo, incluyó 200 pacientes con micro carcinoma papilar de tiroides, un tamaño >6 mm fue asociado a metástasis ganglionar central y combinar con el SUV máximo, mejora la sensibilidad sin cambiar la especificidad.
No hay evidencia a la fecha de este documento que soporte la utilidad de pruebas genéticas para determinar el pronóstico y crecimiento de micro carcinomas papilares. En micro carcinomas la evidencia sigue siendo contradictoria respecto a las mutaciones y relación con peores desenlaces (metástasis, recurrencia, entre otros). Algunos autores no han reportado asociación con mutaciones BRAF19, mientras que otros, han reportado prevalencias de la mutación BRAF en el 45,7% y de la mutación TERT en el 8,7% de los pacientes, las cuales se asociaron a metástasis a distancia y menor supervivencia libre de metástasis. Por lo cual se podría pensar que las pruebas moleculares tendrían algún impacto en estos pacientes de micro carcinoma; sin embargo, a la fecha los resultados siguen sin ser conclusivos y se requiere nueva evidencia de buena calidad que permita soportar decisiones y recomendaciones en la práctica clínica cotidiana30.
¿Cuándo realizarla y con qué periodicidad?
La duración y frecuencia de la vigilancia activa depende del juicio clínico posterior al análisis individualizado del riesgo del paciente20, en términos de la mortalidad, la recurrencia, la respuesta al tratamiento e incluso la remisión de la enfermedad. La edad, la tasa de crecimiento tumoral o inicio de metástasis son imperativos para tener en cuenta en el momento de definición de seguimientos, tal como en el caso de pacientes menores de 30 años con micro carcinomas papilares unifocales, sin evidencia de extensión extracapsular o metástasis12. Existe acuerdo en la literatura en la definición de crecimiento tumoral concebida como el incremento de tres o más milímetros10 o un aumento significativo de volumen mayor al 50% respecto a las mediciones basales9. Se han descripto tres patrones de cinética tumoral: incremento estable exponencial, estabilidad y disminución en el volumen tumoral. Recientes publicaciones sugieren que tumores con tiempo de duplicación del volumen tumoral menores a cinco años serían más agresivos.
Si durante el seguimiento se observa un crecimiento significativo del nódulo tiroideo o la aparición de ganglios linfáticos cervicales sospechosos de malignidad, considerar fuertemente suspender la VA y convertir a cirugía tiroidea.
Como bien mencionamos, teniendo en cuenta nuestro contexto social, contamos con ciertas limitaciones para el seguimiento de los pacientes, pero no lo consideramos imposible, siempre buscando calidad de vida para el paciente.
Puntos para tener en cuenta al hallarnos frente a un paciente ideal para Vigilancia Activa en nuestro hospital:
Decisión del paciente
El paciente debe conocer a cabalidad la estrategia, debe existir compromiso firme de su parte para el seguimiento y estar decidido a realizar vigilancia activa como alternativa terapéutica. Consideramos que el aspecto más importarte y esencial para decidir vigilancia activa en nuestro medio, es el compromiso y entendimiento del paciente, además creemos obligatorio la existencia de un consentimiento informado.
Ecografía confiable
La ecografía debe contar con los datos necesarios para definir el riesgo de invasión con la mayor exactitud posible, además de la precisión en cuanto al aumento de tamaño o de las características en el seguimiento.
Considerar reunión clínica para los potenciales casos de Vigilancia Activa.
Sistema de agendamiento especial.
Para una mayor organización, y mejor manejo de estos pacientes, creemos conveniente la creación de un método exclusivo de agendamiento para estos pacientes.
RECOMENDACIONES
Se recomienda considerar la perspectiva del paciente en la decisión de manejo, brindando una consejería completa con información clara sobre el riesgo de cáncer de tiroides, el proceso diagnóstico, alternativas de tratamiento y las limitaciones asociadas. Fuerte a favor.
Se recomienda brindar atención multidisciplinaria al paciente con sospecha o confirmación citológica de CDT, incluyendo especialistas en endocrinología, radiología y psicología. Fuerte a favor.
Se recomienda realizar vigilancia activa en pacientes ideales definidos por edad mayor a 60 años, presencia de micro carcinoma papilar de tiroides (nódulos menores a 1 cm), márgenes bien definidas, sin evidencia de extensión extra tiroidea y no adyacentes a la cápsula tiroidea, sin compromiso ganglionar. Fuerte a favor.
Se sugiere analizar el inicio de la vigilancia activa, en candidatos adecuados o adultos >60 años, con presencia de otros nódulos de apariencia benigna o características ecográficas de tiroiditis, o la proximidad cercana a la cápsula tiroidea (≤2 mm de tejido tiroideo normal entre el nódulo y la cápsula tiroidea). Débil a favor .
Se recomienda no realizar vigilancia activa en candidatos no adecuados, es decir, aquellos con características ecográficas sospechosas de extensión extra tiroidea o ganglios linfáticos subcentimétricos sospechosos de malignidad en compartimiento central o lateral del cuello o metástasis a distancia. Fuerte a favor.
Se recomienda la realización de ecografía de tiroides y ganglios linfáticos de cuello como seguimiento en aquellos pacientes bajo vigilancia activa. Fuerte a favor .
Se recomienda la realización de ecografía tiroidea durante el seguimiento con una periodicidad semestral o anual. Débil a favor .
Se recomienda realizar un reporte estandarizado de la ecografía en el seguimiento, que incluya las características de la glándula tiroidea, además de la cantidad de nódulos, tamaños (3 diámetros), forma, ecogenicidad, contorno (márgenes), presencia de macro y microcalcificaciones, relación con la tráquea (ángulo), estado de la capsula, patrón vascular y adenopatías cervicales. Fuerte a favor .
Se recomienda convertir a cirugía cuando el paciente cambie de preferencia, haya evidencia de crecimiento de nódulo tiroideo de al menos 3 mm o >a 50% del volumen basal, incidencia de metástasis en ganglio linfático o a distancia, invasión de nervio laríngeo recurrente, tráquea o esófago. Fuerte a favor .
No se recomienda la realización de pruebas moleculares con fines de vigilancia activa, al menos hasta que haya evidencia que respalde su utilidad en estos casos. Opinión de expertos .
CONCLUSIONES
La guía de tratamiento de Cáncer de tiroides está orientada a realizar recomendaciones basadas en la evidencia científica, y adaptadas a nuestro medio.
En particular, la vigilancia activa surge como una estrategia válida de manejo del micro carcinoma de tiroides, una entidad, cuya sobrevida y pronóstico es muy favorable aun sin cirugía.
El manejo de estos pacientes mediante vigilancia requiere un conocimiento profundo del riego individual del cáncer de tiroides y las diferentes clasificaciones, así como de experiencia en la estrategia. Debe primar la elección de los pacientes altamente seleccionados, ya sea en cuanto a características como edad, conformidad y compromiso del seguimiento, así como características del tumor y del equipo médico especializado en dicho manejo.