Introducción
Las plantas nombradas comúnmente como menta, son plantas herbáceas del género Mentha, con una colección de más de 60 especies pertenecientes a la familia Lamiaceae, se originó en la cuenca del Mediterráneo y se extendió por todo el mundo, tanto por medios naturales como artificiales (Tucker, 2006), las especies M. arvensis y M. piperita son las comercialmente más valiosas y más difundidas en todo el mundo (Wei et al., 2023). De manera que M. arvensis, es muy utilizada y tiene una gran demanda en las industrias cosméticas, farmacéuticas y de alimentos (Manh y Tuyet, 2020; Kim et al., 2021; Souza et al., 2014). También es una planta ampliamente utilizada con fines terapéuticos debido a la gran diversidad de compuestos bioactivos aislados e identificados, principalmente en las partes aéreas de las plantas (Silva et al., 2022). Sus aceites esenciales son muy valiosos (Mystkowska et al., 2016), además, es muy apreciada por su aroma, siendo el componente principal del mismo, el mentol, en especial la especie M. arvensis, presentando por estas características su importancia en diferentes industrias (Masumoto y Ito, 2023). Además, para extraer los compuestos con propiedades medicinales de la menta, en especial para el consumo tradicional, éstas pueden pasar por diferentes procesos como: infusión, maceración, decocción para el consumo popular (Soares et al., 2015).
En el Paraguay, la especie, M. arvensis fue introducida entre los años 1970 a 1980, por los colonos brasileños, que la plantaban como "cultivo de cabecera" en suelos recién habilitados ('rozado') que luego de cuatro a cinco años de plantación, eran desplazados por cultivos de soja y maíz (Resquín et al., 2011), en la actualidad el cultivo de la Mentha spp. (M. arvensis; M. piperita; M spicata) se encuentran diseminadas en toda la región Oriental, principalmente en pequeñas fincas, la producción es muy valorada como rubro alternativo, relevante dentro de la diversidad agrícola de renta, las principales industrias yerbateras del país utilizan la materia prima para la elaboración de la yerba mate compuesta, ya que esta hierba es uno de los principales ingredientes de este producto, y su consumo es muy aceptado en el mercado local (Camps, 2008; Resquín et al., 2011; Armadans et al., 2020). También ha sido muy empleada tradicionalmente, desde su introducción, como una planta medicinal, mediante la preparación de infusiones para su consumo (Pin et al., 2009).
Para la propagación de esta especie, tradicionalmente se utilizan las estacas como material vegetativo, este método tiene desventajas como la lentitud en la multiplicación y el hecho de que, al igual que en otras especies que se multiplican de forma vegetativa, se emplea como material de propagación una parte cosechable de la planta. Sin embargo, una técnica, denominada cultivo de tejidos ha demostrado su utilidad en la solución de ambos problemas en numerosas especies, entre ellas las mentas (Godoy et al., 2005).
El “cultivo de tejidos” ó “cultivo in vitro”, es una herramienta biotecnológica que se basa en la micropropagación de plantas bajo condiciones controladas (luz, temperatura, humedad, entre otros factores), además para el éxito de esta técnica, se requieren condiciones de asepsia de los explantes, para lo cual se eliminan los microorganismos contaminantes, utilizando diferentes métodos de desinfección, que no dañen al explante y permitan la multiplicación a gran escala (Castillo, 2004). La micropropagación comprende diferentes etapas, siendo la etapa 0, la selección y tratamiento de la planta madre, la etapa 1, involucra la desinfección y el establecimiento, la etapa 2, la regeneración, la etapa 3, en el cual se da el desarrollo de la plántula, mediante el crecimiento radicular y aéreo, y la etapa 4, en el cual la vitroplanta completó su crecimiento, y se procede a la aclimatación, en donde se prepara a las plantas con la finalidad de hacer frente condiciones ambientales, y es fundamental ajustar todas estas etapas para tener éxito con esta técnica, para una propagación a gran escala (Loberant y Altman, 2010).
La micropropagación in vitro de plantas presenta algunas ventajas ante la propagación convencional como el espacio reducido que se requiere, los factores que influencian la regeneración vegetativa como los nutrientes, hormonas, luz y temperatura pueden ser modificados según los requerimientos de cada especie, así como la obtención de clones, la producción puede durar todo el año (George, 2008). En los últimos tiempos se ha empleado la micropropagación para cultivar de forma masiva diferentes especies de plantas (Sharry, 2015), y tiene importantes papeles en la producción de plantas medicinales con respecto a la independencia de la variación estacional, producción en masa, identificación y producción de clones con las características y condiciones deseadas y la manipulación del microambiente para una mayor producción del metabolito de interés, de gran escala a corto plazo (Beduhn et al., 2016).
Como ya se mencionó, en el mercado paraguayo existe una gran demanda de las especies de Mentha, por ser utilizadas como aditivos en la yerba mate compuesta debido a su sabor y aroma (Armadans et al., 2020), por lo que existen periodos de escases de esta hierba. El desarrollo y uso de esta herramienta para la multiplicación de M. arvensis podría ser de gran utilidad para impulsar avances importantes en la industria nacional. Sin embargo, un obstáculo durante la propagación de especies de menta, sobre todo en la etapa de establecimiento in vitro, es la aparición de abundantes contaminaciones causadas por hongos y bacterias, posiblemente por su hábito de crecimiento y escaso porte (Héctor et al., 2005).
Por todo lo expuesto, y para mejorar las perspectivas de la producción de esta especie, se ha planteado como objetivo del trabajo, el ajuste del protocolo de desinfección para el establecimiento in vitro y posterior evaluación de sustratos más aptos para la aclimatación en casa de vegetación de la menta (Mentha arvensis L.).
Materiales y Métodos
El trabajo de investigación fue realizado en el Laboratorio de Biotecnología, del Centro Multidisciplinario de Investigaciones Tecnológicas (CEMIT), de la Universidad Nacional de Asunción (UNA), entre los meses comprendidos de enero y marzo del año 2023 y constó de dos etapas, 1: Protocolo de desinfección y establecimiento in vitro; y, 2: Protocolo de aclimatación de las vitroplantas en casa de vegetación.
Obtención del material vegetal
Para la obtención de los segmentos nodales, fue seleccionada una planta madre de un stock de plantas de Mentha arvensis provistas por la empresa Industria Yerbatera Santa Margarita S.A. las cuales fueron trasladadas hasta las instalaciones del CEMIT, y se mantuvieron en la casa de vegetación. Las plantas, primeramente, pasaron por un periodo de cuarentena de 21 días, para superar el estrés producido por el traslado de la zona de origen (San Juan, Dpto. de Misiones) hasta el Campus Universitario de la Ciudad de San Lorenzo (Dpto. Central), además de descartar la posible aparición de enfermedades. Una vez pasado este periodo, fue seleccionada la planta madre, según criterios de: buenas condiciones de vigor, sanidad y cantidad de ramas. Para la obtención de los explantes (segmentos nodales con un nudo), fueron cortadas las varas, con una longitud de 20 cm, midiendo desde el ápice de dicha rama. La población total estuvo constituida por 80 segmentos nodales, divididos en 20 segmentos nodales por tratamiento, utilizando 4 repeticiones cada uno.
Desinfección y establecimiento del cultivo in vitro
Las varas colectadas fueron llevadas al laboratorio, inmersas en una solución antioxidante (100 mg/L de ácido ascórbico LASCA®, 50 mg/L ácido cítrico LASCA®, y 100 mg/L de polivinilpirrolidona Sigma-Aldrich®). Para la obtención de los explantes, las varas fueron cortadas en secciones de 2 cm aproximadamente, que contenían un nudo con yemas axilares, además les fueron retiradas las hojas. Posteriormente se realizó un lavado de con agua corriente e inmersión en una solución de 1L de agua y 6 gotas de Tween 20 con agitación leve durante 5 minutos. Posteriormente se procedió a la desinfección según los diferentes tratamientos descritos en la Tabla 1.
Tabla 1. Diferentes tratamientos para la desinfección de segmentos nodales de M. arvensis.
| Tratamientos | NaClO | Tiempo de exposición (minutos) |
|---|---|---|
| T1 | 1 % | 10 |
| T2 | 1,5 % | 10 |
| T3 | 1 % | 15 |
| T4 | 1,5 % | 15 |
Este procedimiento fue realizado en la cámara de flujo laminar, al finalizar los diferentes tratamientos de desinfección, se les realizó un triple enjuague con agua destilada estéril.
Cultivo in vitro de explantes
A continuación, se procedió a la siembra de los explantes en el medio de cultivo MS Sigma® (Murashige y Skoog, 1962) al 100 %, con adición de 30 g/L de sacarosa Anedra®, 2 g/L de carbón activado Biopak®, 6 g/L de agar Sigma®, y se ajustó a un pH de 5,8. Posteriormente el medio preparado se vertieron en tubos de 20 mL de capacidad con 10 mL del medio y fueron esterilizados en autoclave a una temperatura de 121°C y 1 atm. durante 15 minutos.
La siembra de los explantes se realizaron en la cámara de flujo laminar, los segmentos nodales desinfectados (T1, T2, T3 y T4), depositando un segmento por tubo. Una vez realizada la siembra, los tubos se incubaron en el cuarto de cultivo a 26°C ± 1 y a oscuridad total por cinco días, para posteriormente pasar a un periodo de 16 horas luz mediante tubos fluorescente 900 lúmenes y 8 horas de oscuridad.
Veintiún días posteriores a la siembra, ya se observaron crecimiento aéreo y desarrollo radicular de las vitroplantas en todos los tratamientos, que permitieron realizar las evaluaciones de las diferentes variables:
1- Contaminación: Observación de la aparición de hongos y/o bacterias (observación macroscópica y microscópica de las colonias y los cuerpos de fructificación).
2- Sobrevivencia: Determinación de número de explantes necrosadas y no necrosadas.
3- Vitrificación: Observación de explantes translúcidos.
Para el porcentaje de establecimiento de las vitroplantas se consideró las 20 unidades experimentales compuestas en cada tratamiento.
Una vez finalizadas las evaluaciones de las variables mencionadas, se seleccionaron las vitroplantas que presentaron condiciones saludables, además de: altura de la parte aérea, largor y número de raíces para proceder a la aclimatación de estas.
Aclimatación de vitroplantas
Para la evaluación de la aclimatación de las vitroplantas se procedió a la siembra de diferentes tipos sustratos: Perlita, Sustrato comercial estándar Carolina® (turba de sphagno, vermiculita expandida, calcáreo, yeso, NPK); y Perlita + sustrato comercial (1:1).
Para la siembra en casa de vegetación (casa de vegetación tipo pampeano), se procedió a retirar las vitroplantas del medio de cultivo, se enjuagaron con abundante agua corriente, atendiendo a que no queden restos del medio de cultivo. Luego, fueron sumergidas en una solución fungicida compuesta de 4 g/L de sulfato de cobre en agua, durante 5 minutos para evitar la aparición de hongos y su deshidratación en el proceso de cambio de sustrato. Posteriormente se trasplantaron en recipiente de plástico de 200 mL, con los diferentes sustratos, según tratamientos: ENT#091;T1= perlita; T2=sustrato comercial Carolina® y T3= perlita + sustrato comercial (1:1)ENT#093;, una vez trasplantadas las plántulas, fueron cubiertos con un recipiente de plástico con la finalidad de proporcionar un efecto de una cámara húmeda.
Una vez terminada la siembra, los recipientes fueron mantenidos en el cuarto de cultivo en condiciones controladas. Al tercer día se realizaron pequeños orificios en el extremo derecho e izquierdo para el intercambio gaseoso. Al décimo día, los plantines fueron llevados a la casa de vegetación. En la figura 1, se observan los diferentes pasos mencionados, desde la selección de la planta madre, hasta la aclimatación de las vitroplantas.
Análisis de datos
Los resultados de los diferentes ensayos y tratamientos fueron sometidos a un análisis de varianza. Las medias se compararon entre sí mediante la prueba de Tukey al 5 % de nivel de significancia, mediante el Software estadístico InfoStat® (2008).
Resultados
Desinfección para establecimiento in vitro
Transcurridos 21 días posteriores a la siembra in vitro de los explantes, se realizaron las evaluaciones de las variables para la identificación del efecto de los tratamientos de desinfección, las cuales son observadas en la Figura 2. El tratamiento con el mejor control de hongos (Figura 2a) fue el T2 (1,5 % NaClO-10 minutos), el cual registró un 100 % del control de estos microorganismos. Además, en los tratamientos T3 (1 % NaClO-15 minutos) y T4 (1,5 % NaClO-15 minutos) se pudo observar un 95 y 90 % de desinfección de los explantes en los tratamientos, respectivamente, no presentando diferencias estadísticamente significativas con el T2. Mientras que el tratamiento T1 (1 % NaClO-10 minutos) fue el que presentó mayor contaminación con hongos y es diferente estadísticamente significativo a los demás tratamientos.
Para el porcentaje de oxidación (Figura 2b), hubo diferencias estadísticas, resultando los mejores tratamientos, la desinfección de los tratamientos T3 (1 % NaClO-15 minutos) y T4 (1,5 % NaClO-15 minutos) respectivamente, el tratamiento que presentó mayor porcentaje de oxidación fue el tratamiento T2 (1,5 % NaClO-10 minutos).
En cuanto al control de contaminantes bacterianos, presentaron en promedio un 91 % de plantas libre de contaminación, siendo el T3 el que logró un control del 100 %, junto con el T4 presentaron menor contaminación bacteriana respecto a los tratamientos T2 y T1 (Figura 2c). Sin embargo, no existen diferencias significativas en cuanto a la contaminación por bacterias entre métodos de desinfección evaluados. De igual manera para el parámetro de porcentaje de vitrificación (Figura 2d), no hubo diferencias significativas entre los diferentes tratamientos, presentando porcentajes de vitrificación que fueron del 15 al 25 %. Cotejando todas las variables evaluadas se puede mencionar que el mejor tratamiento, fue el tratamiento T4: NaClO 1,5 % por 15 minutos, el cual presentó un porcentaje de plantas saludables en un 80 %, y el tratamiento que tuvo menor porcentaje de establecimiento in vitro (60 % de pérdidas de vitroplantas) fue el tratamiento T1: NaClO 1 % por 10 minutos.
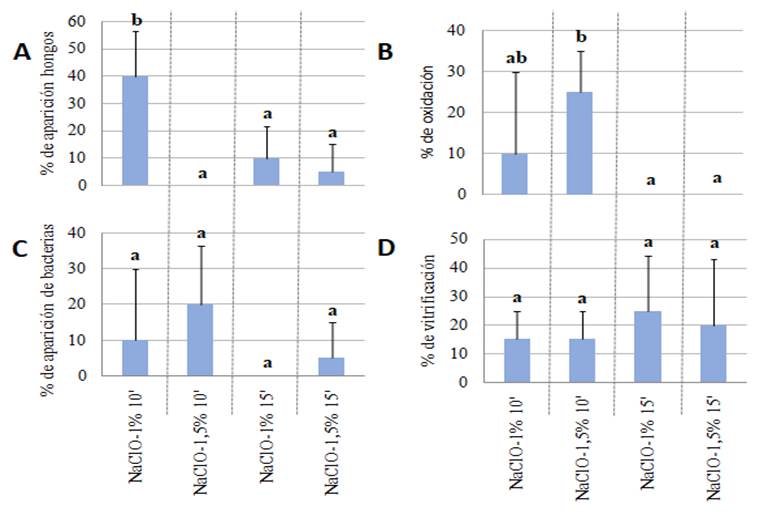
Figura 2. Resultados en diferentes parámetros de desinfección: a) Porcentaje de aparición de hongos en los diferentes tratamientos. b) Porcentaje de oxidación en los diferentes tratamientos. c) % de aparición de bacterias en los diferentes tratamientos. d) Porcentaje de vitrificación en los diferentes tratamientos. Aclimatación en casa de vegetación.
Las evaluaciones fueron realizadas a los 21 días posteriores al trasplante de las vitroplantas, los valores obtenidos se pueden apreciar en la Tabla 2.
Tabla 2. Resultados de los diferentes tratamientos para la aclimatación de vitroplantas de M. arvensis.
| Variables | Tratamientos# | |||
| T1 (Media(DE) | T2 (Media(DE) | T3 (Media(DE) | CV | |
| Sobrevivencia (%) | 91,6(28,86a | 91,6(28,86a | 100(0a | 14,41 |
| Altura (cm) | 10(4,49b | 19(7,39a | 18(4,55a | 15,58 |
| N° de brotes | 0,7(0,49b | 2,5(1,56a | 3(1,56a | 39,54 |
#Comparación de medias por el Test de Tukey: Medias seguidas por la misma letra no difieren entre sí, medias seguidas por letra diferente difieren entre sí, en el nivel de significancia del 5 % InfoStat®. DE: Desviación estándar, CV: Coeficiente de variación.
Para el porcentaje de sobrevivencia se puede observar que no hubo diferencia significativa, arrojando valores de 91,6 a 100 % de sobrevivencia en todos los tratamientos. Por otro lado, evaluando el desarrollo de la planta (altura y números de brotes) si se pudo observar que hay diferencias significativas, siendo los mejores los tratamientos T2 y T3, que utilizaron sustrato comercial y sustrato comercial + perlita 1/1 respectivamente.
Discusión
La regeneración en condiciones in vitro, tuvo un éxito del 80 % en el mejor tratamiento, este valor dista en un poco más del 20 %, según los reportados por Faisal et al. (2014), que, evaluando la multiplicación in vitro de M. arvensis, tuvo un éxito de regeneración en términos de porcentaje de 92 %. Según Gomes et al. (2015) las especies del género Mentha presentan diferentes potenciales de propagación in vitro, siendo M. piperita, M. longiflora y M. arvensis, las de mayor potencial de propagación y en general, la mayor tasa de multiplicación para las especies de Mentha se obtiene a partir del 3er subcultivo. Los mismos autores mencionan que se estima que, el potencial de producción de estas especies, en condiciones in vitro, varía dependiendo de cada especie.
Contaminación por bacterias y hongos
Según Héctor et al. (2005) un obstáculo durante la propagación de especies de menta, sobre todo en la etapa de establecimiento in vitro, es la aparición de abundantes contaminaciones causadas por hongos y bacterias, posiblemente por su hábito de crecimiento y escaso porte de la especie. Como ya se vio, en el caso de la contaminación por bacterias, en el presente trabajo, los tratamientos con mayor aparición fueron T1, y T2, con una concentración de NaClO 1 % y 1,5 % respectivamente por 10 minutos, en este ensayo, más que la concentración del agente desinfectante, tuvo efecto el tiempo de exposición de los explantes, ya que los que tuvieron un mayor tiempo de inmersión tuvieron nulo o menor aparición de bacterias, estos resultados tuvieron mayor éxito que lo reportados por Héctor et al. (2005), que mencionan, en sus resultados de investigación, que, en su método de desinfección de M. arvensis mediante la utilización de alcohol 70 % por 1 minuto y solución de NaClO comercial al 5,5 % diluido al 15 % por un periodo de 10 minutos, la contaminación por bacteria fue del 95 %. El método empleado en el presente trabajo resultó ser más efectivo contra bacterias. Borges et al., 2009, evaluando distintas concentraciones de hipoclorito de sodio (1,5; 2 y 2,5 %), en diferentes tiempos de inmersión para el establecimiento in vitro de Discorea alata, encontraron que, el mejor tratamiento fue en la concentración de NaClO al 1,5 % por 30 minutos de inmersión, que tuvo un efecto del 90 % para la desinfección.
Así mismo, en la presente investigación, la mayor parte de los microorganismos contaminantes fueron hongos filamentosos y bacterias. Folgueras et al. (2001) y Rodriguez et al. (2008), mencionan que los contaminantes más comunes durante en establecimiento in vitro de explantes, extraídos de plantas adultas corresponden a hongos filamentosos y bacterias.
Oxidación y Vitrificación
Sharry (2015) menciona que el carbón activado puede absorber compuestos que promueven la oxidación de las plantas, como los compuestos fenólicos y taninos, además de algunos ácidos como el ácido benzoico, ácido caprílico y ácido pelargonio. Fridborg et al. (1978) mencionan que estos compuestos influyen en el desarrollo correcto de las plantas cultivadas in vitro. Cabe resaltar que en la presente investigación se utilizaron 2 g/L de carbón activado Biopak® en todos los tratamientos, para anular o disminuir la oxidación de las vitroplantas.
A pesar de la utilización del carbón activado y antioxidantes, previo a la desinfección, se observaron plántulas con síntomas de oxidación. A la vez se observó el efecto de vitrificación, según Perugorría Larroque (2012) para evitar los efectos de hiperhidricidad o vitrificación es necesario emplear en el medio de cultivo compuestos como el floroglucinol, ácido cítrico y el ácido ascórbico los cuales ayudan a que la vitrificación sea menor.
Aclimatación en casa de vegetación
En cuanto a la sobrevivencia de las plantas de menta, en la casa de vegetación, se observó que no existen diferencias significativas en cuanto al sustrato utilizado, donde el T1 y T2 presentan un promedio de supervivencia aproximado del 92 %, y el T3 presenta el 100 % de plantas aclimatadas. Valores similares fueron registrados por Vacca-Molina et al (2015), los cuales propagando plántulas de menta obtuvieron una tasa de supervivencia del 100 % utilizando como sustrato humus de lombriz (orgánico y muy rico en nutrientes) y una combinación de perlita:arena:humus en proporción (1:1:1).
En el parámetro altura de plantas, se observó que existe una diferencia significativa en T1 respecto al T2 y T3. Presentando aproximadamente una diferencia de 10 cm en promedio. Esto pudo deberse al sustrato utilizado, debido a que el T1 (perlita) no proporciona un soporte ni retención de agua, esto no permite que la planta pueda desarrollarse en su máxima plenitud. Espinosa-Reyes et al. (2019) mencionan que el tipo de sustrato utilizado tiene un efecto significativo en el crecimiento de las plantas, sugiriendo utilizar estiércol vacuno en combinación con suelo y zeolita debido a que esto se asocia con un mejor desarrollo de las plantas.
En cuanto al número de brotes obtenidos por planta, también se observa que existe una diferencia significativa en el tratamiento 1, presentando en promedio 1 brote por planta. Esto puede asociarse nuevamente al sustrato utilizado. Sin embargo, las plantas que contienen el sustrato comercial responden de manera positiva en cuanto a brotación, lo que afirma que el sustrato perlita en proporción 100 % no es favorable para realizar la aclimatación de plántulas de menta obtenidas in vitro.
Conclusión
En el presente trabajo se logró el establecimiento in vitro de segmentos nodales de M. arvensis, obteniendo los mejores resultados para contar con plántulas asépticas en los tratamientos de desinfección 3 y 4, con una concentración de NaClO al 1 % y 1,5 % por 15 minutos de inmersión.
En la etapa de aclimatación se obtuvieron muy buenos resultados en líneas generales, pero el mejor tipo de sustrato fue el sustrato comercial Carolina® + perlitas dando un 100 % de plantas regeneradas con buen rebrote y follaje. Por otra parte, no se recomienda el empleo de perlita al 100 % como sustrato, ya que el crecimiento se ve disminuido.
La micropropagación de M. arvensis resulta bastante prometedora como alternativa de producción agrícola en Paraguay para la multiplicación masiva del cultivo.












 uBio
uBio 



