Introducción
La morera negra (Morus nigra, Línneo 1753) pertenece a la familia Moraceae. Esta fruta no climatérica se cosecha durante los meses de septiembre y octubre en el hemisferio sur. El fruto de la morera es de 2 a 4 cm de largo, de forma ovalada con un color rojo brillante antes de la plena madurez y es de color negro purpura cuando está completamente maduro (Darias-Martín et al., 2003; Tao et al., 2017). La mora es conocida por su alto valor nutricional y su rico contenido en compuestos bioactivos saludables como las antocianinas, tiene una temporada de cosecha corta y es susceptible de descomponerse durante el transporte y almacenamiento (Wang et al., 2013). El procesamiento completo de esta fruta incluye la elaboración de varios productos, como mermelada, jugo, jarabe, vinagre y bebidas alcohólicas (Tao et al., 2017).
Saccharomyces cerevisiae, utilizada en la industria de la panificación como agente leudante, es la principal cepa de levadura responsable de la fermentación alcohólica. La eficiencia de las cepas de levadura está determinada por su capacidad para utilizar sustancias azucaradas, su tolerancia y capacidad de producción de etanol (Karki et al., 2017). Sin embargo, otras características que a menudo se desean para la fermentación de bebidas son los efectos potenciadores de la calidad, como la generación de compuestos aromáticos deseables (Tao et al., 2017; Yezbick et al., 2013).
La producción de vino a partir de frutas distintas de la uva ha aumentado en los últimos años. Cualquier fruta que tenga una buena proporción de azúcar puede usarse para hacer vino. Los vinos reciben principalmente el nombre de la fruta con la que se han preparado (Varakumar et al., 2013). Hay diferentes tipos de bebidas alcohólicas relacionadas con la mora, como el vino de mora (Juan et al., 2012), el Yakju bebida alcohólica tradicional coreana enriquecida con morera (Kwak et al., 2012) y un destilado producido por fermentación en estado sólido de morera negra en Galicia (Alonso González et al., 2010).
En algunas localidades de zonas turísticas de la provincia de Misiones existe una tendencia creciente de emprendedores a elaborar vinos artesanales con frutas regionales. Sin embargo, los mismos no cuentan prácticas de corrección en el proceso de elaboración y conocimiento microbiológico que garantice un estándar de calidad, dificultando en última instancia, la difusión del producto. En este contexto, este trabajo se centró en la identificación y caracterización de la levadura más representativa de las pulpas frescas de moras con capacidad fermentadora para la producción de vino de mora.
Materiales y Métodos
Recolección de muestras
Los frutos de tres ejemplares sanos del árbol de mora (“mora”, morera negra) se recolectaron en Posadas, provincia de Misiones (27°24'12.6" S - 55°56'40.4" W), en bolsas de plástico de polietileno estéril y se transportaron refrigeradas al laboratorio.
Fermentación del jugo de mora y aislamiento de levaduras tolerantes
Las frutas fueron lavadas dos veces en agua destilada y luego procesadas en una licuadora. El jugo de mora con etanol (99,5%, Cicarelli, Argentina) al 3% (p/v), se mantuvo un tanque de fermentación de 1 litro a 20°C, con una atmósfera estable y casi completamente oscura durante 72 h. La fermentación se analizó para seleccionar las levaduras tolerantes al etanol en la flora nativa presente (Wang et al., 2013).
Una alícuota (5 ml) de jugo fermentado se diluyó en serie (10-1-10-5) y se sembraron (100 µl) en placa con medio Saboraud-agar (Britania S.A., Argentina) suplementado con antibiótico (cloranfenicol, 50 mg/L; Britania S.A., Argentina) y se incubó a 28°C ± 0,5% (San Jor SL30C, Argentina) durante 2-4 días (Peña y Arango, 2009). Las colonias de levaduras obtenidas se subcultivaron hasta obtener colonias purificadas que se almacenaron en medio mínimo Cary-Blair con glicerol a -20ºC.
Identificación genética de levaduras tolerantes
La identificación de las levaduras con tolerancia al etanol se realizó utilizando la técnica de PCR y comparación de secuencias de ADNr descrita por White y col. (White et al., 1990). La mezcla de reacción contenía cebadores específicos para la región D1 / D2 de la gran subunidad ribosómica (28S rDNA), NL-1 (5-GCATATCAATAAGCGGAGGAAAAG-3) y NL-4 (5-GGTCCGTGTTTCAAGACGG-3). La PCR se inició a 94°C durante 3 min y 30 ciclos de desnaturalización a 94°C durante 1 min, hibridación (annealing) 55°C durante 1 min, extensión a 72°C durante 5 min, con una extensión final a 72°C por 5 min. Los productos de amplificación se separaron por electroforesis en un gel de agarosa al 1% (p/v) y se tiñeron con SYBR Green (Invitrogen, USA). Luego, los productos se purificaron usando kit AccuPrep (Bioneer, Corea del Sur). La secuenciación se realizó en Macrogen (Seúl, Corea del Sur) utilizando el kit de reacción listo para secuenciación del ciclo terminador BigDye (Applied Biosystems). Las secuencias se editaron manualmente y se alinearon para generar una secuencia consenso usando la herramienta Clustal W (Thompson et al., 1994). Las búsquedas de similitud se llevaron a cabo usando el programa BLAST N del sitio web http://www.ncbi.nlm.nih.gov (Altschul et al., 1990).
Tolerancia al etanol
Se adoptó el criterio de tolerancia como la concentración de etanol que reduce el crecimiento de las levaduras en un 50% (I50) (Ramírez-Cota et al., 2021). Empleando el medio sintético en condiciones estáticas investigamos la capacidad de tolerancia al etanol de la cepa M01-IX. Se midió el crecimiento de las cepas de levadura a distintas concentraciones de etanol, según You con modificación (You et al., 2003). Cada cultivo se inició inoculando matraces Erlenmeyer de 50 ml que contenían 10 ml de medio líquido YPD (Yeast Peptone Dextrose) (extracto de levadura 10 g/l, peptona 20 g/l, glucosa 20 g/l) suplementado con 5%, 7% y 10% (v/v) de etanol a una densidad óptica (DO) a 660 nm (DO660) 0,02 (2,5x105 células por ml) con células de cultivos en fase media logarítmica en crecimiento activo y se incubaron a 30°C durante 3 días (72 h). El crecimiento fue monitoreado por DO cada 24 h. La cepa comercial Saccharomyces cerevisiae (Calsa S.A., Argentina) se utilizó como referencia.
Los valores medios y sus desviaciones estándar del crecimiento celular se calcularon a partir de muestras por sextuplicado. Los resultados de los experimentos fueron evaluados mediante análisis de varianza (ANOVA) y prueba de Tukey post-hoc para determinar diferencias con significación estadística a un nivel de confianza del 95%. El I50 se estimó mediante la regresión logística no lineal de cuatro parámetros conocida como ecuación de Hill (Gadagkar & Call, 2015). Todos los análisis fueron realizados con el paquete estadístico Statgraphics Centurion XVI.
Fermentación discontinua estática
Las fermentaciones discontinuas se realizaron a escala de laboratorio en matraces de agitación de 250 ml que contenían 100 ml de medio YPD, suplementado con sacarosa e inoculados a DO 0,02 (2,5x105 células por ml). En medio sintético luego de la esterilización en autoclave a 121ºC por 15 minutos se produce aparición de fructosa por la hidrólisis de sacarosa (Chen, 2004).
El contenido de carbohidratos en la mora se encuentra entre un 5-11%, lo que resulta insuficiente para alcanzar contenido alcohólico aceptable por lo que se adiciona sacarosa para alcanzar 16ºBrix (Darias-Martín et al., 2003; Juan et al., 2012). El pH inicial fue de 6,5 para todos los ensayos. Los matraces se incubaron a 30°C durante aproximadamente 120 h. Al comienzo de los experimentos y cada 8 a 12 h, las muestras fueron recogidas para su análisis. La densidad óptica y el consumo de azúcar se midieron en el caldo como se describe en Métodos analíticos. Cada ensayo se realizó por duplicado.
Determinación de parámetros cinéticos de crecimiento y rendimiento
Los parámetros cinéticos velocidad específica de crecimiento, tiempo de latencia y tiempo de generación se calcularon utilizando el modelo de Gompertz. Los parámetros de ajuste del modelo de Gompertz fueron calculados por regresión no lineal con el programa estadístico Statgraphics Centurion (versión 16.0) utilizando el algoritmo Marquard (Rivas et al., 2014). El rendimiento de biomasa YX/S (gramos de biomasa producidos por gramo de azúcar consumido) y el rendimiento de etanol YE/S (gramos de etanol producidos por gramo de azúcar consumido) se calcularon como la pendiente, ajustada por regresión lineal, de los valores correspondientes de biomasa o etanol producido versus azúcar total consumido en los intervalos de tiempo correspondientes (Rodrigues et al., 2015).
Métodos analíticos
La DO se midió usando un espectrofotómetro (Shimadzu UV-2550, Japón) a 660 nm. Los valores se convirtieron en concentración de biomasa (g/l) mediante el uso de una curva estándar. La biomasa se determinó mediante centrifugación (Zelían S.A., Argentina) de 1 ml de cultivo en tubos pesados previamente a 5.000 rpm durante 5 min. Se retiró el sobrenadante y el sedimento se secó en estufa y se pesó en una balanza de precisión (APX-200, Denver Instrument, USA), hasta peso constante (Peña y Arango, 2009).
Los análisis de azúcares se realizaron por cromatografía líquida de alto rendimiento (HPLC) utilizando muestras previamente centrifugadas a 13.000 g durante 5 min. Los análisis se realizaron en un HPLC Shimadzu Prominence LC20 AT (Japón) equipado con un detector de índice de refracción ERC 7522 (ERMA INC, Japón). Para analizar las concentraciones de azúcar se usó una columna Zorbax amino NH2 4,6 x 250 mm, 5 um (Agilent, USA) con una fase móvil de acetonitrilo/agua (85:15), elución isocrática con un flujo de 2 ml/min. a 35°C.
Resultados
Selección e identificación de levaduras
A partir de los muestreos realizados, 10 cepas recuperadas de la fermentación alcohólica del jugo de mora mostraron el carácter morfológico de la levadura en placas con medio selectivo. El aislado M01-IX fue seleccionado debido a su abundancia relativa, y los otros nueve aislados no fueron estudiados. El análisis de la secuencia parcial (606 pb) del aislado M01-IX (GenBank: MH844381.1) determinó un alto porcentaje (100%) de similitud con Saccharomyces cerevisiae (MK908002.1).
Prueba de tolerancia al etanol
El crecimiento a diferentes concentraciones de etanol se presenta en la Tabla 1. Los resultados muestran que la cepa silvestre M01-IX puede crecer a todas las concentraciones ensayadas, sin embargo, el crecimiento se redujo significativamente en función del incremento de alcohol. En la cepa de referencia las diferencias en el crecimiento son significativas a partir de 7% de alcohol. En la Tabla 2, se presentan los parámetros de la ecuación Hill, los cuales indican que las cepas presentan diferentes tolerancias al etanol, siendo I50 5% y 8% para las cepas M01-IX y referencia, respectivamente.
Tabla 1. Tolerancia al etanol en cultivos estáticos a 30ºC.
| Cepa | Horas | Control | 5% | 7% | 10% |
| S. cerevisiae M01-IX | 24 | 1,195 ± 0,14 | 0,270 ± 0,72a | 0,162 ± 0,04a | 0,108 ± 0,03a |
| 48 | 3,512 ± 0,26 | 1,343 ± 0,24b | 0,451 ± 0,04b | 0,136 ± 0,03b | |
| 72 | 7,590 ± 0,54 | 4,050 ± 0,60 c | 0,826 ± 0,12c | 0,256 ± 0,07c | |
| S. cerevisiae (referencia) | 24 | 2,946 ± 0,15 | 2,412 ± 0,17 | 2,014 ± 0,16e | 0,220 ± 0,07d |
| 48 | 7,250 ± 0,25 | 6,760 ± 0,33 | 5,327 ± 0,45e | 1,183 ± 0,84d | |
| 72 | 7,980 ± 0,46 | 6,890 ± 0,53 | 6,298 ± 0,20e | 2,190 ± 1,79d |
Los valores de crecimiento corresponden al valor promedio de DO (660 nm) corregidos y sus desvió estándar. a,b,cPresentan diferencias significativas con respecto al control (0% de etanol) de la cepa M01-IX para 5%, 7% y 10% de etanol a las 24, 48 y 72 hs (respectivamente). d,ePresentan diferencias significativas con respecto al control (0% de etanol) de la cepa de referencia para 7% y 10% de etanol a las 24, 48 y 72 hs (respectivamente).
Tabla 2. Parámetros de la ecuación de Hill para S. cerevisiae.
| Cepa | R2 | Coeficiente | Estimador | Error estándar | Intervalo de confianza 95% |
| S. cerevisiae M01-IX | 99,7 | C | 0,01 | 0,11 | -0,24 a 0,27 |
| D | 8,03 | 0,09 | 7,82 a 8,23 | ||
| I50 | 5,02 | 0,04 | 4,92 a 5,12 | ||
| b | 6,57 | 0,58 | 5,29 a 7,85 | ||
| S. cerevisiae (referencia) | 83,6 | C | 0,22 | 6,47 | -13,50 a 13,95 |
| D | 7,38 | 0,47 | 6,37 a 8,39 | ||
| I50 | 8,34 | 3,54 | 0,83 a 15,84 | ||
| b | 5,35 | 5,32 | -5,93 a 16,63 |
C es el crecimiento de las levaduras en la concentración máxima de etanol utilizada en cada serie experimental, D es el crecimiento de las levaduras en ausencia de etanol, I50 es la concentración de etanol que reduce el crecimiento del microorganismo en 50%, b es la pendiente de Hill, R2 es el coeficiente de determinación de la regresión no lineal. Todos los modelos y coeficientes resultaron significativos (p ≤ 0.05).
Fermentación discontinua estática
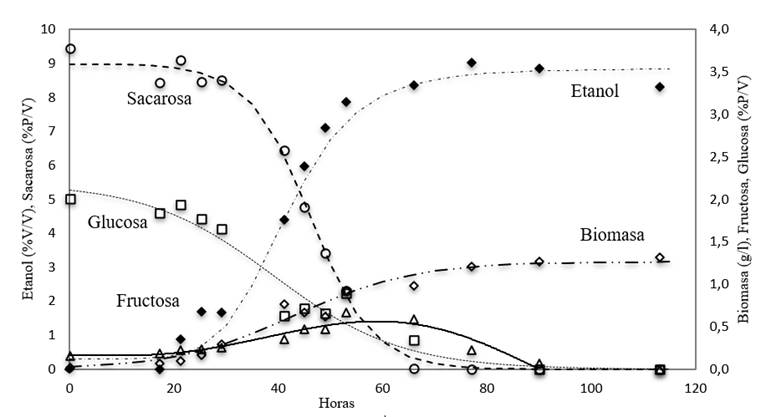
El crecimiento, el consumo de azúcar y la producción de etanol se muestra para la cepa M01-IX en la Figura 1. La cepa silvestre M01-IX se caracterizó por (1) un crecimiento exponencial inicial que alcanzó la fase estacionaria cuando solo se habían consumido más del 84% de azúcares, (2) 96% del etanol se produjo durante la fase de crecimiento y 4% durante la fase estacionaria, (3) a las 60 hs se alcanzó el máximo de fructosa en solución (15%) y (4) menos del 2% del azúcar residual permaneció sin consumir después de 95 h de cultivo. Se obtuvieron perfiles de crecimiento típicos para levaduras en ambas cepas (M01-IX y referencia) y los valores correspondientes de los parámetros cinéticos y energéticos se muestran en la Tabla 3. Las tasas de crecimiento específico (μ) mostraron diferencias entre las cepas, no así el porcentaje de consumo total de azúcar que fue similar para las cepas M01-IX y referencia. La M01-IX exhibe un tstat más largo, el tiempo necesario para alcanzar la fase estacionaria. Los rendimientos de biomasa y producción de etanol para M01-IX y referencia no mostraron diferencias aparentes.
Tabla 3. Parámetros cinéticos en batch estático a 30ºC.
| Cepa | μ(h-1) | λ(h) | tstat(h) | THC(%) | YX/S(g/g) | YE/S(g/g) |
| M01-IX | 0,06 | 10,5 | 50,12 | 99,88 | 0,027 | 0,408 |
| Referencia | 0,19 | 9,26 | 23,97 | 98,07 | 0,025 | 0,438 |
μ(h-1) velocidad especifica de crecimiento, λ(h) tiempo de latencia, tstat(h) tiempo para alcanzar la fase estacionaria, THC(%) azúcar consumida, YX/S (g/g) rendimiento de biomasa, YE/S(g/g) rendimiento de etanol. Se indican valores medios.
Discusión
Las frutas son fuentes importantes de levaduras debido a su gran cantidad de azúcares simples y a la frecuente visita de vectores. La microbiota natural de las frutas está compuesta comúnmente de levaduras y hongos levaduriformes de los géneros Aureobasidium, Rhodotorula, Sporobolomyces, Cryptococcus, Brettanomyces, Candida, Pichia, Hanseniaspora y raramente Saccharomyces y Schizosaccharomyces (Lee et al., 2011; Mambuscay et al., 2013). En un reporte previo se menciona que, en el jugo de mora la mitad de las especies (Pichia kluyveri, Hansenia sporauvarum y Candida oleophila) reportadas solo cuentan con un aislado, mientras que la especie Wickerhamomyces pijperi está representada por 13 de las 28 cepas aisladas. Las especies Hanseniaspora uvarum y Candida boidinii presentan 6 y 5 cepas respectivamente (Mambuscay et al., 2013). Sin embargo, en nuestro estudio S. cerevisiae fue la especie más abundante.
Tolerancia al etanol
Nuestros resultados indican que la cepa silvestre S. cerevisiae M01-IX tolera hasta un 5% de etanol en el medio de cultivo. Estos resultados están de acuerdos a otros estudios, en donde el rango de tolerancia al etanol en las levaduras fue entre 5 - 12% (Matapathi et al., 2004; Tikka et al., 2013). En S. cerevisiae, el aumento de la concentración de etanol como principal producto de fermentación, influye en la fluidez de membrana, el metabolismo celular y en la biosíntesis de macromoléculas, lo que lleva a la inhibición del crecimiento e incluso a la muerte (Ding et al., 2009; You et al., 2003). Los resultados de análisis de genoma completo y de regulación de transcripción, informan que los genes asociados con la función de la vacuola y la biosíntesis de aminoácidos son importantes para la tolerancia al etanol. La importancia del primero puede estar relacionada con la necesidad de funciones basadas en vacuolas, como la homeostasis del pH intracelular, el mantenimiento de la concentración de iones y la degradación de proteínas, en un momento en que el estrés por etanol ha alterado los gradientes electroquímicos e iniciado una considerable renovación de proteínas en la célula (Stanley et al., 2010; Yang & Tavazoie, 2020).
Fermentación discontinua estática
La capacidad fermentativa se ve influenciada por diferentes factores, como la temperatura, la concentración de azúcares, el pH, y algunas otras variables que influyen en el crecimiento de los microorganismos, es decir, son responsables para una disminución en el rendimiento de biomasa (Rodrigues et al., 2015; Wang et al., 2016). El rendimiento de biomasa en M01-IX fue bajo. Esto es una ventaja en procesos en los que los productos y no la biomasa son el objetivo industrial. Reportes para cepas silvestres de S. cerevisiae indicaron valores de rendimiento de biomasa entre 0,022 - 0,644 g/g (González-Leos et al., 2017). El rendimiento de etanol/azúcar obtenido para M01-IX (0,408 g/g) se encuentra entre los mejores rendimientos reportados para producción de etanol en condiciones similares para cepas silvestres que van de 0,048 - 0,505 g/g (González-Leos et al., 2017). No obstante, reportes indican una clara reducción en la tasa de crecimiento de la levadura cuando el etanol está presente en concentraciones entre 4 y 10 % (p/v) (Lee et al., 2011; Lima-Costa et al.,2012). En este caso, la acumulación de etanol en el medio de cultivo al final de la fase exponencial alcanzó concentraciones del 6,8% (v/v) (Figura 1). Esto sugirió que el etanol presente en el caldo puede ser el factor etiológico de la inhibición del consumo de azúcar y la consiguiente inhibición del crecimiento. Sin embargo, también quedó claro que ambos procesos no se vieron afectados de la misma manera, debido al desacoplamiento entre el crecimiento de biomasa y la producción de etanol en la fase estacionaria, y la capacidad de las células de no crecimiento para mantener una producción lenta de etanol.
Cinética del consumo de azúcares
La tasa de crecimiento puede ser afectada por cambios en la tasa específica de consumo de azúcar (Lima-Costa et al., 2012). El jugo de mora natural posee cantidades similares de glucosa y fructosa, pero no contiene sacarosa (Makhoul et al., 2017). Para obtener mostos fermentables óptimos para la elaboración de vinos debe suplementarse con la adición de azúcar (Darias-Martín et al., 2003). Para conocer el comportamiento de la cepa M01-IX se midió el consumo de los diferentes azúcares (glucosa, fructosa y sacarosa) presentes en el curso de la fermentación (ver, Figura 1). Al inicio (t0) la concentración de glucosa, fructosa y sacarosa en el medio de cultivo eran 20, 4 y 94 g/l., respectivamente. Durante la fase “lag” y la primera fase de crecimiento exponencial (t22 h), solo se consumió glucosa. Durante la segunda fase de crecimiento, la sacarosa se hidroliza, la glucosa es mantenida en concentraciones bajas decreciente, mientras que la concentración de fructosa en ese periodo se triplicó, lo que indica que los monosacáridos producidos por la hidrólisis de la sacarosa se consumieron con diferente preferencia. La tercera fase de crecimiento, fase estacionaria, continua la hidrólisis de sacarosa hasta agotamiento, la glucosa se mantiene en valores bajos e inicia el consumo de fructosa. Nuestras observaciones están en concordancia con reportes previos (Lima-Costa et al., 2012; Rodrigues et al., 2015). En los cultivos de S. cerevisiae la sacarosa es hidrolizada por la enzima invertasa, codificada por el producto del gen Suc2.
En presencia de glucosa en concentraciones mayores a 18mM la síntesis de invertasa es reprimida (Meijer et al., 1998). Por ello, al inicio de la fermentación cuando la glucosa está presente en alta concentración (más de 20 g/l en este caso), la síntesis de invertasa se reprime y no se hidroliza sacarosa. La hexosa permeasa solo trasporta monosacáridos al interior de la levadura, siendo la glucosa mucho más afín. La concentración de glucosa se mantiene baja debido a que es metabolizada a medida que está disponible, en simultáneo la concentración de fructosa aumenta un poco, lo que implica que la tasa de hidrólisis del azúcar es más alta que las tasas de transporte de monosacáridos. En general, la menor afinidad de los transportadores de hexosas por la fructosa en comparación con la glucosa explica el predominio de la fructosa hacia el final de la fermentación (Rodrigues et al, 2015).
Conclusión
Las frutas maduras de la morera negra son fuente de levaduras silvestres con capacidad fermentativa. El aislado M01-IX, identificado como Saccharomyces cerevisiae presenta tolerancia al etanol en las condiciones ensayadas y es capaz de metabolizar el 99% de azúcar disponible durante fermentación, por lo cual presenta una característica adecuada para la elaboración de bebidas de bajo contenido alcohólico y azúcar residual.












 uBio
uBio