INTRODUCCIÓN
Con el análisis químico de suelo se busca predecir la disponibilidad de un elemento nutricional para las plantas de forma barata, eficiente y rápida. Históricamente, han sido desarrollados diferentes métodos de análisis, con el objetivo de disponer de indicadores confiables de su disponibilidad en el suelo, a pesar de ello, aun no hay un método universal para su estimación1. Existen varios métodos de extracción química de fósforo, ya que cada método de acuerdo con su característica es más confiable en determinado tipo de suelo, en los cuales no siempre los resultados obtenidos en los análisis químicos se correlacionan con las cantidades de P absorbidas por las plantas 2.
Entre los extractores más utilizados en el mundo se encuentra el Mehlich-1, que tiene como ventaja ser un extractor multielemental, muy utilizado en suelos ácidos3. Bray & Kurtz4 también propusieron un método rápido para estimar las formas de fósforo disponibles para las plantas, el método conocido como Bray-1 que se trata de una extracción con una solución mezcla de NH4F 0,03N y HCl 0,025N, que se basa en el efecto solubilizador del H+ sobre el P del suelo y la capacidad del ión F- de bajar la actividad del Al+3, evitando la readsorción de los fosfatos en el sistema de extracción5.
Para suelos con pH elevado y/o altos niveles de P y Ca, como en los suelos donde se aplicó fosfato natural, los métodos de extracción ácidos como el Mehlich-1 y Bray-1 pueden extraer P que en realidad no esté disponible para la planta, al menos al corto plazo6,7, por lo que métodos como el uso de extractores como el bicarbonato de sodio desarrollado por Olsen et al.,8 o el de resina de intercambio aniónico (RIA) desarrollado por Amer et al.9, pueden ser utilizados en esos suelos, siendo inclusive el método de RIA, el método oficial de extracción de P para el estado de Sao Paulo, Brasil10. El método del bicarbonato es bastante utilizado, principalmente en suelos próximos a la neutralidad o alcalinos cuyo principio es la liberación del P ligado al Fe y al Al por el aumento del pH, bastante útil para suelos alcalinos donde el ion carbonato substituye al fósforo adsorbido en el suelo y disminuye la actividad del ion Ca en la solución del suelo por la precipitación de este11.
Entre todos los métodos de extracción de P mencionados, ninguno de ellos ha sido calibrado ni validado en los suelos de la región Occidental del Paraguay, es por ello, que el objetivo de este trabajo fue comparar cinco métodos de extracción de P en suelos de la zona del Chaco Central, de manera a determinar si existen diferencias en la cuantificación de P encada método de extracción de análisis.
MATERIALES Y MÉTODO
Las muestras de suelo fueron colectadas en la zona del Chaco Central de la región Occidental de Paraguay, entre los meses de junio y julio del año 2020 en el estrato superficial de 0 a 20 cm de profundidad, en donde cada muestra estuvo conformada por cinco submuestras, colectadas en dos sistemas, una muestra del sistema prístino, en la que el suelo se encuentra inalterado y bajo la vegetación natural, y una muestra de las parcelas contiguas con diferentes usos (uso antrópico). En la figura 1 se observa la distribución geográfica de los puntos y en la tabla 1 se observan los puntos muestreados con su identificación y coordenadas geográficas correspondientes. Una vez colectadas las muestras, éstas fueron remitidas al laboratorio del Área de Suelos y Ordenamiento Territorial de la Facultad de Ciencias Agrarias (FCA) de la Universidad Nacional de Asunción, donde se secaron en la sala de secado a sombra, a temperatura ambiente durante una semana, posteriormente las muestras de suelo se tamizaron en tamiz Nº 10 (2 mm de apertura de malla) y luego se acondicionaron las mismas en recipientes de 100 ml para posterior realización de los análisis correspondientes, entre los meses de julio y agosto de 2020.
Figura 1 Distribución geográfica de los puntos de colecta de suelo en el Chaco Central, Región Occidental, Paraguay. 2020. Fuente: Google Earth
Tabla 1 Referencias de los 38 puntos muestreados en forma pareada, pH(agua) del suelo en la camada de 0-20 cm y sus usos en el Chaco Central, Región Occidental.
| Punto de muestreo | Coordenadas | pH | Identificación | |
|---|---|---|---|---|
| Latitud | Longitud | |||
| A1 | 22°14'21" S | 60°02'15" O | 5,9 | Bosque matorral. Vegetación: Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire) y Puede ser Bromelia serra Griseb. (karaguata) |
| A2 | 22°14'27,46" S | 60°02'10,76" O | 6,6 | Pasturas: Megathyrsus maximus Jacq (gatton panic o hierba de guinea), malezas Nicotiana glauca Grahan (mbelen mbelen), Calotropis procera (Aiton) W.T. Aiton (tuja bola) |
| B1 | 21°34'34,28"S | 60°44'28,17"O | 6,8 | Bosque xerófito. Vegetación: cactáceas, Aspidosperma quebracho-blanco Schltdl. (quebracho blanco), ciperáceas. |
| B2 | 21°34'40,26"S | 60°42'18,40"O | 6,0 | Barbecho químico para cultivo de soja (Glycine max L. Merr.). Malezas: Conyza sp. (Mbu´y) |
| C1 | 22°17'26,43"S | 59°58'43,05"O | 6,4 | Monte natural. Vegetación: Ceiba chodatii (Hassl.) Ravenna (samu'u) |
| C2 | 22°17'24,27"S | 59°58'53,11"O | 6,7 | Citricultura de más de 60 años |
| D1 | 22°19'38,40"S | 60°4'17,82"O | 5,2 | Monte natural. Vegetación: Neltuma sp. (algarrobo), Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire), cactáceas, ciperáceas |
| D2 | 22°19'52,10"S | 60°4'6,30"O | 6,1 | Cultivo de uva (Vitis vinifera L.). Uso anterior, Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs var. maximus (gatton panic o hierba de guinea) |
| E1 | 22°24'13,94"S | 60°3'39,25"O | 5,5 | Monte natural |
| E2 | 22°24'26,05"S | 60°3'19,83"O | 6,4 | Parcela agrícola: cultivo de sésamo (Sesamum indicum L.) y barbecho |
| F1 | 22°23'20,62"S | 60°2'55,06"O | 5,4 | Bosque matorral. Vegetación: Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire), cactáceas, Aspidosperma quebracho-blanco Schltdl. (quebracho blanco) Schinopsis balansae Engl. (quebracho colorado) |
| F2 | 22°23'22,63"S | 60°2'50,32"O | 5,6 | Barbecho químico para pastura, parcela en rotación agrícola a forrajera. Malezas: gramíneas y de hoja ancha (Portulaca sp, Ipomoea sp, Amaranthus sp., Calotropis procera (Aiton) W.T. Aiton (tuja bola)) |
| G1 | 22°18'7,08"S | 59°53'31,24"O | 5,6 | Monte natural. Vegetación: Aspidosperma quebracho-blanco Schltdl. ((Schltr.) (quebracho blanco) Schinopsis balansae (Engl) (quebracho colorado) |
| G2 | 22°17'55,18"S | 59°54'14,35"O | 5,9 | Cultivo de maní Arachis hypogaea L. |
| H1 | 22°19'13,10"S | 60°13'4,04"O | 5,9 | Monte natural. Vegetación: Aspidosperma quebracho-blanco Schltdl. (quebracho blanco), Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire), Ceiba chodatii (Hassl.) Ravenna (samu'u) |
| H2 | 22°19'6,37"S | 60°13'3,27"O | 5,8 | Parcela agrícola: cultivo de sésamo (Sesamum indicum L) |
| I1 | 22°23'20,6"S | 60°09'21,2"O | 6,0 | Monte natural. Vegetación: Ceiba chodatii (Hassl.) Ravenna (samu'u), Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire) |
| I2 | 22°23'22,9"S | 60°09'21,4"O | 5,7 | Parcela agrícola: Arachis hypogaea L. (maní) |
| J1 | 22°14'15,2"S | 59°59'05,1"O | 6,1 | Monte |
| J2 | 22°14'26,9"S | 59°59'01,6"O | 7,4 | Pasturas |
| K1 | 22°25'12,0"S | 60°06'03,6"O | 5,7 | Monte |
| K2 | 22°14'26,9"S | 259°59'01,6"O | 6,3 | Pastura: Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs var. maximus (gatton panic o hierba de guinea) |
| L1 | 22°29'53,68"S | 59°43'58,85"O | 5,1 | Monte |
| L2 | 22°29'49,15"S | 59°43'59,26"O | 6,0 | Parcela agrícola: Arachis hypogaea L. (maní), barbecho |
| M1 | 22°20'37,73"S | 60°3'38,75"O | 5,6 | Monte |
| M2 | 22°21'05,45"S | 60°03'20,2"O | 5,5 | Uso forestal |
| N1 | 22°06'30,7"S | 60°07'39,4"O | 6,2 | Monte. Vegetación: Salta triflora (Griseb.) Adr. Sánchez (Guaiguî pire), Ceiba chodatii (Hassl.) Ravenna (samu'u) |
| N2 | 22°06'30,9"S | 60°07'44,0"O | 6,1 | Parcela agrícola: pastura y luego maíz (Zea mays L.) |
| O1 | 22°27,155'S | 61°3,143'O | 6,6 | Monte |
| O2 | 22°27,377'S | 61°3,177'O | 6,1 | Parcela agrícola: Arachis hypogaea L. (maní) |
| P1 | 22°18'51,68"S | 61°48'38,37"O | 6,5 | Monte |
| P2 | 22°19'07,32"S | 61°48'29,40"O | 6,9 | Parcela agrícola. Rotación de: soja, algodón, trigo, sésamo. 6 años de uso. Riego con aguas profundas |
| Q1 | 22°27,759'S | 59°31,119"O | 5,7 | Monte |
| Q2 | 22°27,892'S | 59°31,067"O | 4,7 | Parcela de ensayo: variedades de clones de Eucalyptus sp. (eucalipto). Cultivo perenne de eucaliptos 10 años de evaluación, asociado al sistema silvopastoril con Urochloa sp. (pasto brachiaria) |
| Q3 | 22°27,867'S | 59°31,220"O | 5,2 | Cultivo perenne de Leucaena leucocephala (Lam.) De Wit (leucaena) con sistema silvopastoril. Alimentación de ganado. 5 años de uso |
| Q4 | 22°30,238'S | 59°28,03'O | 4,9 | Parcela de ensayo: variedades de pasturas para pastoreo directo, 1 año de instalación. Antes pastura Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs var. maximus (gatton panic o hierba de guinea) |
| R1 | 23°00'47,19"S | 61°49'54,10"O | 6,7 | Monte. Vegetación: Tessaria integrifolia L. (palo bobo) (No será Tessaria dodoneifolia (Hook. & Arn.) Cabrera ssp. dodoneifolia, llamado comúnmente palo bobo?) |
| R2 | 22°59'47,81"S | 61°47'15,76"O | 6,8 | Pasturas: Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs var. maximus (gatton panic o hierba de guinea) |
El estudio estuvo desarrollado según un diseño de bloques completos al azar, dispuestos en un arreglo bifactorial, donde el factor A corresponde a los usos del suelo (prístino y antrópico) y el factor B corresponde a los métodos de análisis [Mehlich-1, Bray & Kurtz, Mehlich-3, Olsen y Resina de Intercambio iónico (RIA)], con 19 repeticiones, totalizando 38 unidades de análisis. En el laboratorio de suelo cada una de las 38 muestras fueron analizadas por triplicado para un mejor diagnóstico.
En el laboratorio, las muestras fueron secadas al aire, se tamizaron con malla de 2 mm y posteriormente fueron pesadas alícuotas de 1 g de suelo en tubos Falcon de 50 mL. Las extracciones de P disponible se realizaron de acuerdo con las siguientes metodologías:
Mehlich 1: extracción con H2SO4 0,0125 M + HCl 0,005 M, relación suelo-extractante (1:10), tiempo de agitación 5 min en agitador horizontal 12.
Olsen: extracción con NaHCO3 0,5 M a pH 8,5, relación suelo-extractante (1:20), tiempo de agitación 30 minutos en agitador horizontal 8,13.
Mehlich 3: extracción con CH3COOH 0,2 M + NH4NO3 0,25 M + NH4F 0,015 M + HNO3 0,013 M + EDTA (ácido etilendiaminotetraacético) 0,001 M, relación suelo-extractante (1:10), tiempo de agitación 5 min en agitador horizontal 14,15.
Bray-1: extracción con HCl 0,025 M + NH4F 0,03 M (pH<2,9), relación suelo-extractante (1:10), tiempo de agitación 1 min en agitador horizontal 4.
Resina de intercambio aniónico (RIA): saturación de RIA con NaHCO3 0,5 M a pH 8,5, posterior agitación de estas con 10 ml de agua destilada por 16 h en agitador del tipo “end-over-end”, seguido, se extrajeron las resinas fueron colocadas en HCl 0,5 M, relación suelo-extractante (1:10), tiempo de reposo 1h 30 min y agitación de 30 min en agitador horizontal 16.
El P extraído fue determinado espectrofotométricamente con espectrofotómetro marca Quimis, modelo Q898DPT, mediante la lectura de la intensidad de color del complejo fosfomolibdato, producido por la reducción del molibdato por acción del ácido ascórbico, en extractos ácidos utilizando el método de Murphy & Riley17.
Los resultados obtenidos fueron procesados y sometidos a análisis de varianza al 5% de probabilidad de error, con la utilización del programa estadístico Infostat18, y cuando se detectaron diferencias estadísticamente significativas (p<0,05) se realizó la comparación de medias por el test de Tukey al 5%. También se analizó la correlación entre los niveles de P extraído por las soluciones extractoras.
RESULTADOS Y DISCUSIÓN
Entre los usos de suelo, prístino y antrópico no se observaron diferencia estadística en la concentración de P según el análisis de varianza, pero sí entre las metodologías de extracción de P. No hubo interacción entre los dos factores estudiados (Tabla 2).
Tabla 2 Fósforo extraído por efecto del sistema de uso del suelo y metodología de extracción de fósforo. 2020.
| Tratamientos | Concentración de fósforo (mg kg-1) |
|---|---|
| Uso del Suelo | |
| Prístino | 100 ns |
| Antrópico | 110 |
| DMS | 19,5 |
| Métodos de análisis | |
| Bray 1 | 198 a* |
| Mehlich 1 | 172 a |
| Mehlich 3 | 79 b |
| Olsen | 44 bc |
| RIA | 33 c |
| DMS | 43,8 |
| CV (%) | 66,3 |
ns: No significativo; DMS: Diferencia mínima significativa; *Letras minúsculas diferentes en las columnas indican diferencias estadísticas entre sí (p<0,05).
Los suelos del Chaco Central, por más de que son utilizados desde hace años para fines agropecuarios, mantienen altos niveles de fósforo presentes naturalmente, que aún no han descendido de forma considerable como para que se observen diferencias entre los suelos prístinos y los de uso antrópico, al menos en las muestras extraídas y determinadas en este estudio que incluyó suelos cuyo uso en algunos casos supera inclusive los 50 años. En otros tipos de suelos como los de orden Oxisol y Ultisol, situados en la región Oriental es común que en los suelos de uso antrópico, principalmente de uso en agricultura empresarial se caractericen por poseer mayores niveles de P que los suelos prístinos, ocasionados por la adición de fertilizantes fosfatados que reponen lo extraído por los cultivos, y su vez el empleo de prácticas conservacionistas que evitan las pérdidas de este nutriente en el suelo, sin embargo, en el Chaco paraguayo en general no se agrega fertilizante fosfatado. Contrario a los resultados obtenidos en esta investigación, Novello y Quintero 19, mencionan, que, en suelos con uso agrícola, es notoria la disminución de P en los horizontes superficiales. Michelena et al. 20 observaron que el P extraíble en el horizonte superficial de los suelos agrícolas eran de 77% y los de uso agropecuario del 58% cuando se comparaban con suelos prístinos.
Entre los diferentes métodos de extracción de P evaluados, se evidenció diferencias estadísticamente significativas para las concentraciones detectadas; las mayores cantidades de P fueron extraídas por Bray-1 (183 mg kg-1) y Mehlich-1 (156 mg kg-1), estos dos extractores mostraron mayor valor de P que el extractor Mehlich-3 (58 mg kg-1) que presentó valores estadísticamente similares al extractor Olson, (42 mg kg-1). El que menos P extrajo fue la RIA (30 mg kg-1), siendo solo comparable con el extractor Olsen (Tabla 2).
Los extractores multinutrientes Bray-1 y Mehlich-1, no presentaron diferencias estadísticas significativas entre ellos, siendo que las extracciones de P superiores de estos dos métodos, en comparación a los demás métodos, en suelos neutros a alcalinos, como los del Chaco Central, ocurre porque estos métodos tienden a sobre estimar las concentraciones de P, considerando que los mismos solubilizan formas de P no disponibles para las plantas, principalmente en suelos alcalinos y en aquellos donde son aplicados fosfato natural, polvo de roca o gallinaza. Es así, que Bray y Kurtz 4, mencionan que el método Bray-1 solubiliza minerales apatitícos. A su vez, el método Mehlich 1, ha recibido críticas, debido a la excesiva extracción de P ligado al Ca 21.
Cabe resaltar que desde el punto de vista de la practicidad en el laboratorio, los métodos Mehlich 1, Mehlich 3 y Bray-1 son métodos multinutrientes que además de servir para la extracción de P, también son utilizados para la determinación de K, Fe, Mn, Zn y Cu, lo que facilita el análisis en el laboratorio, frente a los métodos Olsen y RIA que son exclusivos para fósforo. Además, los métodos Mehlich 1 y Bray-1 son más recomendados para suelos ácidos, que no son característicos del Chaco Central. El método Mehlich-3, por su parte, presentó diferencias estadísticas significativas con los mencionados anteriormente, ya que extrajo menos P, y a su vez se distingue del método RIA, ya que extrajo más cantidad de P que la RIA, sin presentar diferencias estadísticas con el método Olsen.
El multiextractante Mehlich-3 puede emplearse en una amplia gama de suelos, tanto neutros como alcalinos, como los suelos objeto de estudio, porque la acidez del extractante es poco neutralizada con la presencia de carbonato de calcio en los suelos. Bortolón & Gianello 22 y Pereira (23, no observaron diferencia entre el Mehlich-1 y Mehlich-3 en suelos ácidos, inclusive Bortolón & Gianello 22 obtuvieron valores de P mayores con el Mehlich-3.
La extracción con Olsen, presentó diferencias con Bray-1 y Mehlich-1, pero no con los métodos Mehlich-3 y RIA, posicionándolo como uno de los más aptos para su uso en los suelos neutros o calcáreos, con pH entre 5,5 a 8,5, ya que como mencionan Zalba et al., 24) se basa en el control de la actividad de los iones calcio, durante la extracción de P en suelos calcáreos, y además, extrae algo de fosfato ligado a hierro y aluminio, siendo por ello, un buen extractante para un amplio rango de pH del suelo.
El método RIA, fue el que extrajo la menor cantidad de P entre todos los métodos evaluados, presentó diferencias estadísticas significativas con los métodos Bray-1, Mehlich-1 y Mehlich-3, en cambio no presentó diferencias significativas con el método Olsen, este método es considerado como el más apto para las determinaciones de P en los suelos con aplicación de cal agrícola, o sea con pH elevado como serían los suelos del Chaco, ya que, según Arruda et al.2 el RIA es un indicador más sensible de la disponibilidad de P en el suelo corregidos que el extractor Mehlich-1.
En la tabla 3 y la figura 2 se presentan las correlaciones de los niveles de P extraído del suelo por las soluciones Mehlich-1 y los demás extractores, con alto grado de correlación entre Mehlich-1 y Bray-1 (r=0,96**), Mehlich-1 y Mehlich-3 (r=0,94**), Mehlich-1 y Olsen (r=0,84**), Mehlich-1 y RIA (r=0,91**). En el caso de los métodos Mehlich-1 y Bray-1, ambos son para extracción multinutrientes que además de extraer el P ligado al Fe y el Al poseen capacidad de extraer el P ligado al Ca 25, forma de fósforo que abunda en los suelos del Chaco 26.
Tabla 3 Tabla de análisis de correlación entre los diferentes extractores de fósforo. 2020
| Mehlich-1 | Bray-1 | Mehlich-3 | Olsen | |
| Bray-1 | r=0,96** <0,0001 | |||
| Mehlich-3 | r=0,94** <0,0001 | r=0,91** <0,0001 | ||
| Olsen | r=0,84** <0,0001 | r=0,90** <0,0001 | r=0,91** <0,0001 | |
| RIA | r=0,91** <0,0001 | r=0,88** <0,0001 | r=0,95** <0,0001 | r=0,91** <0,0001 |
r= coeficiente de correlación; ** Altamente significativo p <0,0001
Por otro lado, el extractor Mehlich-3 presentó buena correlación con el Mehlich-1, aunque éste por ser un método de extracción multinutriente menos agresivo por poseer ácidos débiles, extrae menos cantidad de P que el Mehlich-1, justamente el P ligado al Ca, que en pH próximo a la neutralidad no está disponible para los cultivos.
Los extractores Olsen y RIA, que serían los recomendados para suelos próximos a la neutralidad, presentan menor correlación con el Mehlich-1 que los métodos anteriores, sin embargo, aún con coeficientes bastante elevados y altamente significativos. Todos los métodos empleados en el estudio extraen diferentes cantidades de P de los suelos. Moreno et al.27, comparando diferentes métodos de extracción de P, no encontraron buena correlación entre los mismos para los suelos de la Región Occidental.
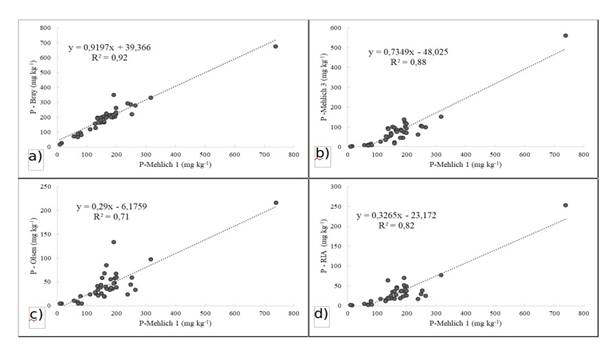
Figura 2 Coeficiente de determinación y ecuaciones entre los niveles de P extraído por las soluciones de Mehlich-1 y de Bray & Kurtz (2a), Mehlich-1 y Mehlich-3 (2b), Mehlich-1 y de Olsen (2c), Mehlich-1 y de RIA (2d).
Considerando que existe diferencia en el nivel de P de acuerdo con los extractores, en un segundo paso se debe implantar experimentos a campo para verificar cuál de ellos se relaciona mejor con la disponibilidad de fósforo para las plantas. Por lo tanto, lo que se evidencia inicialmente es la necesidad de validar los métodos de extracción de P para los suelos del Chaco Central, ya que, la utilización de un método inadecuado puede tanto sobre como subestimar la disponibilidad de P para los cultivos.
CONCLUSIONES
Los métodos extraen diferentes cantidades de fósforo de los suelos. Los extractores ácidos extraen mayor cantidad de fósforo que el método de Olsen o el de resina de intercambio aniónico y posiblemente estos últimos sean los más recomendados para suelos del Chaco Central donde predominan los de pH neutro o ligeramente ácido.












 uBio
uBio 


