1. INTRODUCCIÓN
El Cerrado es un gran bioma tropical que ocupa unos 2 millones de km2 en el centro de Sudamérica, incluyendo gran parte del centro de Brasil, partes del noreste de Paraguay y el este de Bolivia1-3. Comprende tres formaciones vegetales: las formaciones forestales, que se caracterizan por presentar mayormente árboles con un dosel continuo o discontinuo; las formaciones sabánicas, que contienen árboles y arbustos sin un dosel continuo, dispersos sobre un estrato de hierbas; y las formaciones campestres, que presentan predominancia de especies herbáceas y algunos arbustos3.
El Cerrado es el segundo bioma más grande de Sudamérica, después del Amazonas, y está clasificado entre los 25 hotspots terrestres más importantes para la conservación en el mundo4-6. No obstante, menos del 5% de su superficie se preserva en áreas protegidas1,7,8.
En el Paraguay, el Cerrado se encuentra distribuido en áreas discontinuas y de extensiones variables9, y es considerado de máxima prioridad para la conservación10. Las pocas áreas protegidas que conservan este bioma en la región Oriental son el Parque Nacional Cerro Corá del Departamento de Amambay11, la Reserva Natural de Tati Yupi y Yvyty Rokái en el Departamento de Alto Paraná12,13, la Serranía San Luis y el Parque Nacional Paso Bravo en el Departamento de Concepción14,15, y la Reserva Natural del Bosque Mbaracayú en el Departamento de Canindeyú11,16. Esta última con dos zonas de Cerrado: Ñandurokái y Aguará Ñu17.
Considerando estos antecedentes, se resalta la importancia de la implementación de estudios florísticos periódicos que proporcionen información sobre la composición de especies de las diferentes formaciones vegetales, además de un análisis de sus similitudes o diferencias, como una parte importante de la evaluación del estado de conservación de estas áreas protegidas.
En este sentido, el objetivo de este estudio fue realizar una evaluación ecológica rápida de la flora nativa de la formación forestal y sabánica del Cerrado Aguará Ñu, Reserva Natural del Bosque Mbaracayú de Paraguay, determinando la riqueza de especies y las diferencias de composición entre las mismas, de manera a complementar los levantamientos florísticos ya existentes(11,16,-19).
2. METODOLOGÍA
2.1. Área de estudio
El estudio se llevó a cabo de enero a marzo de 2020, en el noreste del Paraguay, en la Reserva Natural del Bosque Mbaracayú, en el Departamento de Canindeyú. Específicamente en el interior del Cerrado Aguará Ñu, un área ubicada en el límite oriental de esta Reserva, y que tiene aproximadamente 7000 hectáreas (Figura 1)16,20. La Reserva Natural del Bosque Mbaracayú es un área protegida privada, gestionada por la Fundación Moisés Bertoni, donde el acceso está restringido a personas extrañas20. Sin embargo, nuestra investigación se llevó a cabo mediante el permiso de acceso otorgado por del Ministerio de Ambiente y Desarrollo Sustentable de Paraguay (Protocolo #004/2020).
Según la clasificación de Köppen, el Cerrado Aguará Ñu tiene un clima subtropical húmedo (Cfa), con una temperatura y una precipitación anual promedio de alrededor de 20°C y 1800 milímetros, respectivamente. Tiene dos estaciones bien definidas: una seca y fría (abril - septiembre), y otra húmeda y calurosa (octubre - marzo)20,21. Sus suelos se clasifican como ultisoles y alfisoles. Los suelos del tipo ultisol se originan en las areniscas y tienen un paisaje ondulado, sin rocas y con buen drenaje. Mientras que los suelos del tipo alfisol corresponden a llanuras de inundación de ríos y arroyos con un drenaje pobre y sin rocas20,22.
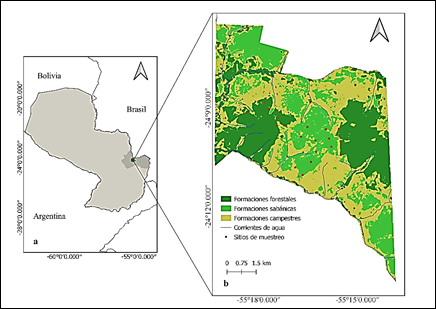
Figura 1 Área de estudio. (a) Reserva Natural del Bosque Mbaracayú (verde oscuro), dentro del departamento de Canindeyú (gris oscuro), Paraguay (gris claro). (b) Formaciones vegetales del Cerrado Aguará Ñu: forestales (verde oscuro), sabánicas (verde claro) y campestres (amarillo claro), corrientes de agua (azul), y sitios de muestreo (puntos rojos).
Como es típico, el Cerrado Aguará Ñu comprende tres tipos de formaciones vegetales: forestales, sabánicas y campestres, que albergan una gran diversidad de plantas nativas y endémicas16,17,19. La Fundación Moisés Bertoni es pionera en el manejo bajo el régimen de fuego del Cerrado Aguará Ñu, desde su inclusión al área protegida entre el año 1992 y 1994, con una frecuencia anual y zonificada, cuyo criterio principal de incorporación es la acumulación de biomasa (Claudia Rolón, comunicación personal). Por esta razón, la mayor parte de la vegetación de las formaciones sabánicas presentan adaptaciones en forma de xilopodios, rizomas, bulbos y otros órganos subterráneos en las especies herbáceas, y cortezas suberificadas y tallos tortuosos en las especies leñosas y arbustivas17.
2.2. Muestreo
Fueron muestreadas dos formaciones vegetales del Cerrado: la forestal y la sabánica. Se utilizaron diez transectos de 50 m x 2 m, totalizando 1000 m2 por cada formación23,24. La distribución de los transectos fue realizada en gabinete, teniendo en cuenta una distancia mínima de 100 m entre sí, y evitando las zonas de alteración antrópica como el camino interno y el puesto de control. La ubicación preseleccionada se registró con un geoposicionador satelital, y posteriormente se definió en campo en base a la accesibilidad y a situaciones particulares (como la presencia de enjambres de abejas en los transectos).
En cada transecto se realizó un inventario de la flora vascular nativa mediante una evaluación ecológica rápida con identificación in situ de las especies25,26. Solamente fueron colectadas muestras de las plantas cuya identificación no fue posible completar en el campo, a las que se asignó un código hasta completar el muestreo. Las plantas colectadas fueron herborizadas y posteriormente depositadas en el Museo Nacional de Historia Natural del Ministerio de Ambiente y Desarrollo Sustentable del Paraguay.
2.3. Análisis de datos
Los datos obtenidos fueron utilizados para construir una matriz de presencia/ausencia por transecto y por formación vegetal, en el que sólo se incorporaron los taxones detectados al menos al nivel de género. Se elaboró una curva de acumulación de especies27, con intervalos de confianza para cada formación vegetal utilizando el programa EStimates28, para evaluar la saturación de la misma en función del esfuerzo de muestreo. Se calculó la riqueza de especies esperada e intervalos de confianza para cada formación vegetal, utilizando el estimador Chao II29. Esto permitió estimar la tasa de efectividad de la evaluación ecológica rápida (es decir, el porcentaje de la flora nativa detectada) según el esfuerzo de muestreo (de uno a diez transectos por formación).
La diferencia en la composición de especies entre las formaciones vegetales se evaluó calculando las distancias de Bray-Curtis. Luego, los valores de diferencia fueron ordenados usando una escala multidimensional no métrica (nMDS por sus siglas en inglés). Posteriormente, esta diferencia se probó estadísticamente mediante el análisis permutacional de las similitudes (ANOSIM). Esta herramienta de análisis permite comprobar la significación estadística de las diferencias entre grupos comparando a la disimilitud dentro de los grupos utilizando el rango de valores de disimilitud30. Todos los análisis estadísticos se realizaron en R 3.5.331, usando el paquete Vegan versión 2.-0432.
3. RESULTADOS Y DISCUSIÓN
Se registró un total de 171 especies de plantas vasculares nativas entre la formación forestal y sabánica del Cerrado Aguará Ñu, pertenecientes a 61 familias. En la formación forestal se identificaron 81 especies dentro de 40 familias, mientras que en la formación sabánica se identificaron 106 especies distribuidas en 40 familias (Tabla 1).
Tabla 1 Lista de especies de plantas nativas identificadas en el estudio y sus frecuencias en cada formación vegetal
| N° | Formación | Familia | Especie | Frecuencia |
| 1 | Forestal | Anacardiaceae | Astronium sp. | 1 |
| 2 | Forestal | Annonaceae | Annona coriacea C. Mart. | 2 |
| 3 | Forestal | Annonaceae | Annona crassiflora Mart. | 1 |
| 4 | Forestal | Annonaceae | Duguetia furfuracea (A. St.-Hil.) Benth. & Hook. f. | 2 |
| 5 | Forestal | Annonaceae | Xylopia aromatica (Lam.) C. Mart. | 2 |
| 6 | Forestal | Apocynaceae | Forsteronia glabrescens Müll. Arg. | 3 |
| 7 | Forestal | Araceae | Thaumatophyllum bipinnatifidum (Schott ex Endl.) Sakur., Calazans & Mayo | 1 |
| 8 | Forestal | Araliaceae | Dendropanax cuneatus (DC.) Decne. & Planch. | 4 |
| 9 | Forestal | Araliaceae | Didymopanax morototoni (Aubl.) Decne. & Planch. | 9 |
| 10 | Forestal | Arecaceae | Acrocomia aculeata (Jacq.) Lodd. ex Mart. | 1 |
| 11 | Forestal | Arecaceae | Butia paraguayensis (Barb. Rodr.) L.H. Bailey | 1 |
| 12 | Forestal | Arecaceae | Syagrus romanzoffiana (Cham.) Glassman | 1 |
| 13 | Forestal | Bignoniaceae | Fridericia florida (DC.) L.G. Lohmann | 2 |
| 14 | Forestal | Bignoniaceae | Handroanthus heptaphyllus (Vell.) Mattos | 1 |
| 15 | Forestal | Bignoniaceae | Jacaranda mimosifolia D. Don | 1 |
| 16 | Forestal | Bromeliaceae | Aechmea bromeliifolia (Rudge) Baker | 1 |
| 17 | Forestal | Bromeliaceae | Bromelia balansae Mez | 4 |
| 18 | Forestal | Bromeliaceae | Pseudananas sagenarius (Arruda) Camargo | 4 |
| 19 | Forestal | Burseraceae | Protium heptaphyllum (Aubl.) Marchand | 7 |
| 20 | Forestal | Clusiaceae | Garcinia brasiliensis Mart. | 1 |
| 21 | Forestal | Combretaceae | Terminalia glabrescens Mart. | 1 |
| 22 | Forestal | Cyatheaceae | Cyathea sp. | 1 |
| 23 | Forestal | Cyperaceae | Scleria sp. | 3 |
| 24 | Forestal | Erythroxylaceae | Erythroxylum cuneifolium (Mart.) O.E. Schulz | 1 |
| 25 | Forestal | Euphorbiaceae | Croton sp. | 1 |
| 26 | Forestal | Fabaceae | Acosmium subelegans (Mohlenbr.) Yakovlev | 2 |
| 27 | Forestal | Fabaceae | Anadenanthera peregrina (L.) Speg. | 3 |
| 28 | Forestal | Fabaceae | Bauhinia sp. | 2 |
| 29 | Forestal | Fabaceae | Copaifera langsdorffii Desf. var. langsdorfii | 9 |
| 30 | Forestal | Fabaceae | Dimorphandra mollis Benth. | 1 |
| 31 | Forestal | Fabaceae | Senegalia polyphylla (DC.) Britton & Rose ex Britton & Killip | 1 |
| 32 | Forestal | Fabaceae | Senna sp. | 1 |
| 33 | Forestal | Lacistemaceae | Lacistema hasslerianum Chodat | 4 |
| 34 | Forestal | Lauraceae | Endlicheria paniculata (Spreng.) J.F. Macbr. | 1 |
| 35 | Forestal | Lauraceae | Nectandra angustifolia (Schrad.) Nees & Mart. | 1 |
| 36 | Forestal | Lauraceae | Nectandra lanceolata Nees & Mart. | 3 |
| 37 | Forestal | Malvaceae | Luehea divaricata Mart. | 1 |
| 38 | Forestal | Melastomataceae | Miconia sp. | 2 |
| 39 | Forestal | Meliaceae | Cabralea canjerana (Vell.) Mart. | 2 |
| 40 | Forestal | Meliaceae | Guarea macrophylla Vahl ssp. spiciflora (A. Juss.) T.D. Penn. | 1 |
| 41 | Forestal | Meliaceae | Trichilia pallida Sw. | 4 |
| 42 | Forestal | Moraceae | Maclura tinctoria (L.) Steud. ssp. tinctoria | 1 |
| 43 | Forestal | Moraceae | Sorocea bonplandii (Baill.) W.C.Burger, Lanj. & Wess.Boer | 2 |
| 44 | Forestal | Myrtaceae | Eugenia uniflora L. | 2 |
| 45 | Forestal | Myrtaceae | Myrciaria cuspidata O. Berg | 3 |
| 46 | Forestal | Myrtaceae | Plinia rivularis (Cambess.) Rotman | 1 |
| 47 | Forestal | Orchidaceae | Oeceoclades maculata (Lindl.) Lindl. | 1 |
| 48 | Forestal | Passifloraceae | Passiflora sp. | 1 |
| 49 | Forestal | Poaceae | Lasiacis divaricata (L.) Hitchc. var. austroamericana Davidse | 1 |
| 50 | Forestal | Poaceae | Merostachys claussenii Munro | 5 |
| 51 | Forestal | Poaceae | Panicum sp. | 1 |
| 52 | Forestal | Polypodiaceae | Microgramma lindbergii (Mett.) de la Sota | 1 |
| 53 | Forestal | Primulaceae | Clavija nutans (Vell.) B. Ståhl | 1 |
| 54 | Forestal | Primulaceae | Myrsine sp. | 6 |
| 55 | Forestal | Rosaceae | Prunus sp. | 1 |
| 56 | Forestal | Rubiaceae | Coccocypselum lanceolatum (Ruiz & Pav.) Pers. | 2 |
| 57 | Forestal | Rubiaceae | Coussarea platyphylla Müll. Arg. | 6 |
| 58 | Forestal | Rubiaceae | Coutarea hexandra (Jacq.) K. Schum. | 1 |
| 59 | Forestal | Rubiaceae | Faramea porophylla (Vell.) Müll. Arg. | 5 |
| 60 | Forestal | Rubiaceae | Geophyla sp. | 1 |
| 61 | Forestal | Rubiaceae | Guettarda viburnoides Cham. & Schltdl. | 2 |
| 62 | Forestal | Rubiaceae | Palicourea crocea (Sw.) Roem. & Schult. | 6 |
| 63 | Forestal | Rutaceae | Helietta apiculata Benth. | 2 |
| 64 | Forestal | Rutaceae | Zanthoxylum rhoifolium Lam. | 1 |
| 65 | Forestal | Salicaceae | Casearia gossypiosperma Briq. | 2 |
| 66 | Forestal | Salicaceae | Prockia crucis P. Browne ex L. | 1 |
| 67 | Forestal | Sapindaceae | Diatenopteryx sorbifolia Radlk. | 1 |
| 68 | Forestal | Sapindaceae | Magonia pubescens A. St.-Hil. | 1 |
| 69 | Forestal | Sapindaceae | Matayba elaeagnoides Radlk. | 1 |
| 70 | Forestal | Sapindaceae | Serjania erecta Radlk. | 1 |
| 71 | Forestal | Sapindaceae | Serjania sp. | 1 |
| 72 | Forestal | Sapindaceae | Talisia esculenta (Cambess.) Radlk. | 1 |
| 73 | Forestal | Sapotaceae | Pouteria ramiflora (Mart.) Radlk. | 2 |
| 74 | Forestal | Schizaeaceae | Schizaea elegans (Vahl) Sw. | 1 |
| 75 | Forestal | Smilacaceae | Smilax sp. | 4 |
| 76 | Forestal | Solanaceae | Solanum lycocarpum A. St.-Hil. | 1 |
| 77 | Forestal | Symploccaceae | Symplocos celastrinea Mart. ex Miq. | 2 |
| 78 | Forestal | Urticaceae | Cecropia pachystachya Trécul | 3 |
| 79 | Forestal | Vochysiaceae | Qualea grandiflora C. Mart. | 3 |
| 80 | Forestal | Vochysiaceae | Qualea sp. | 1 |
| 81 | Forestal | Vochysiaceae | Vochysia tucanorum C. Mart. | 8 |
| 82 | Sabánica | Acanthaceae | Ruellia sp. | 1 |
| 83 | Sabánica | Amaranthaceae | Froelichia procera (Seub.) Pedersen | 2 |
| 84 | Sabánica | Anacardiaceae | Anacardium humile A. St.-Hil. | 1 |
| 85 | Sabánica | Anacardiaceae | Schinus weinmannifolius Endl. var. hassleri (F.A. Barkley) F.A. Barkley | 2 |
| 86 | Sabánica | Anemiaceae | Anemia sp. | 2 |
| 87 | Sabánica | Annonaceae | Annona dioica A. St.-Hil. | 2 |
| 88 | Sabánica | Annonaceae | Duguetia furfuracea (A. St.-Hil.) Benth. & Hook. f. | 7 |
| 89 | Sabánica | Apiaceae | Eryngium elegans Cham. & Schltdl. | 1 |
| 90 | Sabánica | Apiaceae | Eryngium juncifolium (Urb.) Mathias & Constance | 2 |
| 91 | Sabánica | Arecaceae | Acrocomia aculeata (Jacq.) Lodd. ex Mart. | 2 |
| 92 | Sabánica | Arecaceae | Acrocomia hassleri (Barb. Rodr.) W.J. Hahn | 3 |
| 93 | Sabánica | Arecaceae | Allagoptera campestris (Mart.) Kuntze | 5 |
| 94 | Sabánica | Arecaceae | Butia paraguayensis (Barb. Rodr.) L.H. Bailey | 7 |
| 95 | Sabánica | Arecaceae | Butia sp. | 1 |
| 96 | Sabánica | Arecaceae | Syagrus romanzoffiana (Cham.) Glassman | 1 |
| 97 | Sabánica | Asteraceae | Aspilia sp. | 1 |
| 98 | Sabánica | Asteraceae | Baccharis sp. | 2 |
| 99 | Sabánica | Asteraceae | Eupatorium sp. | 1 |
| 100 | Sabánica | Asteraceae | Mikania sp. | 2 |
| 101 | Sabánica | Asteraceae | Orthopappus angustifolius (Sw.) Gleason | 1 |
| 102 | Sabánica | Asteraceae | Stenocephalum hystrix (Chodat) H. Rob. | 1 |
| 103 | Sabánica | Bignoniaceae | Handroanthus ochraceus (Cham.) Mattos ssp. ochraceus | 1 |
| 104 | Sabánica | Bignoniaceae | Jacaranda decurrens Cham. | 1 |
| 105 | Sabánica | Bixaceae | Cochlospermum regium (Schrank) Pilg. | 1 |
| 106 | Sabánica | Boraginaceae | Heliotropium sp. | 1 |
| 107 | Sabánica | Caryocariaceae | Caryocar brasiliense Cambess. ssp. intermedium (Wittm.) Prance & M.F. Silva | 3 |
| 108 | Sabánica | Celastraceae | Tontelea micrantha (Mart. ex Schult.) A.C. Sm. | 3 |
| 109 | Sabánica | Clusiaceae | Kielmeyera coriacea Mart. & Zucc. | 1 |
| 110 | Sabánica | Commelinaceae | Commelina sp. | 1 |
| 111 | Sabánica | Cucurbitaceae | Cayaponia espelina (Silva Manso) Cogn. | 1 |
| 112 | Sabánica | Cyperaceae | Rhynchospora sp. | 1 |
| 113 | Sabánica | Erythroxylaceae | Erythroxylum cuneifolium (Mart.) O.E. Schulz | 4 |
| 114 | Sabánica | Euphorbiaceae | Cnidoscolus maracayensis (Chodat & Hassl.) Pax & K. Hoffm. | 2 |
| 115 | Sabánica | Euphorbiaceae | Croton didrichsenii G.L. Webster | 3 |
| 116 | Sabánica | Euphorbiaceae | Croton serratifolius Baill. | 2 |
| 117 | Sabánica | Euphorbiaceae | Croton sp. | 2 |
| 118 | Sabánica | Euphorbiaceae | Jatropha intermedia (Chodat & Hassl.) Pax | 1 |
| 119 | Sabánica | Euphorbiaceae | Jatropha sp. | 1 |
| 120 | Sabánica | Euphorbiaceae | Julocroton sp. | 1 |
| 121 | Sabánica | Euphorbiaceae | Microstachys hispida (Mart.) Govaerts | 2 |
| 122 | Sabánica | Euphorbiaceae | Sebastiania sp. | 1 |
| 123 | Sabánica | Euphorbiaceae | Stillingia salpingadenia (Müll. Arg.) Huber | 1 |
| 124 | Sabánica | Fabaceae | Acosmium subelegans (Mohlenbr.) Yakovlev | 2 |
| 125 | Sabánica | Fabaceae | Anadenanthera peregrina (L.) Speg. | 3 |
| 126 | Sabánica | Fabaceae | Andira humilis Mart. ex Benth. | 2 |
| 127 | Sabánica | Fabaceae | Bauhinia sp. | 1 |
| 128 | Sabánica | Fabaceae | Calliandra brevicaulis Micheli var. brevicaulis | 1 |
| 129 | Sabánica | Fabaceae | Calliandra longipes Benth. | 1 |
| 130 | Sabánica | Fabaceae | Chamaecrista flexuosa (L.) Greene | 1 |
| 131 | Sabánica | Fabaceae | Chamaecrista sp. | 4 |
| 132 | Sabánica | Fabaceae | Collaea stenophylla (Hook. & Arn.) Benth. | 5 |
| 133 | Sabánica | Fabaceae | Crotalaria sp.1 | 1 |
| 134 | Sabánica | Fabaceae | Crotalaria sp.2 | 1 |
| 135 | Sabánica | Fabaceae | Desmodium sp. | 1 |
| 136 | Sabánica | Fabaceae | Eriosema sp. | 3 |
| 137 | Sabánica | Fabaceae | Mimosa dolens Vell. | 5 |
| 138 | Sabánica | Fabaceae | Mimosa sp. | 3 |
| 139 | Sabánica | Fabaceae | Pomaria rubicunda (Vogel) B.B. Simpson & G.P. Lewis var. hauthalii | 1 |
| 140 | Sabánica | Fabaceae | Stylosanthes guianensis (Aubl.) Sw. var. guianensis | 2 |
| 141 | Sabánica | Fabaceae | Stylosanthes sp. | 2 |
| 142 | Sabánica | Fabaceae | Zornia sp. | 1 |
| 143 | Sabánica | Gesneriaceae | Sinningia allagophylla (Mart.) Wiehler | 1 |
| 144 | Sabánica | Iridaceae | Trimezia spathata (Klatt) Baker ssp. martii (Baker) Ravenna | 2 |
| 145 | Sabánica | Lamiaceae | Hyptis sp. | 2 |
| 146 | Sabánica | Lauraceae | Nectandra lanceolata Nees & Mart. | 1 |
| 147 | Sabánica | Lythraceae | Cuphea sp. | 1 |
| 148 | Sabánica | Malpighiaceae | Byrsonima sp. | 1 |
| 149 | Sabánica | Malvaceae | Sida sp. | 4 |
| 150 | Sabánica | Malvaceae | Waltheria sp. | 1 |
| 151 | Sabánica | Melastomataceae | Tibouchina sp. | 1 |
| 152 | Sabánica | Myrtaceae | Campomanesia adamantium (Cambess.) O. Berg | 7 |
| 153 | Sabánica | Myrtaceae | Campomanesia sessiliflora (O. Berg) Mattos | 3 |
| 154 | Sabánica | Oxalidaceae | Oxalis sp. | 3 |
| 155 | Sabánica | Plantaginaceae | Scoparia sp. | 1 |
| 156 | Sabánica | Poaceae | Andropogon sp. | 1 |
| 157 | Sabánica | Poaceae | Aristida sp. | 5 |
| 158 | Sabánica | Poaceae | Axonopus cfr. siccus (Nees) Kuhlm. | 9 |
| 159 | Sabánica | Poaceae | Axonopus suffultus (J.C. Mikan ex Trini.) Parodi | 4 |
| 160 | Sabánica | Poaceae | cfr. Gouinia sp. | 2 |
| 161 | Sabánica | Poaceae | Ctenium polystachium Balansa | 3 |
| 162 | Sabánica | Poaceae | Digitaria sacchariflora (Nees) Henrard | 1 |
| 163 | Sabánica | Poaceae | Eragrostis sp. | 1 |
| 164 | Sabánica | Poaceae | Eustachys distichophylla | 2 |
| 165 | Sabánica | Poaceae | Gouinia brasiliensis (S. Moore) Swallen | 2 |
| 166 | Sabánica | Poaceae | Heteropogon contortus (L.) P. Beauv. Ex Roem. & Schult. | 5 |
| 167 | Sabánica | Poaceae | Oedochloa procurrens (Nees ex Trin.) C.Silva & R.P. Oliveira | 1 |
| 168 | Sabánica | Poaceae | Panicum bergii Arechav. | 4 |
| 169 | Sabánica | Poaceae | Paspalum cfr. chacoense Parodi | 1 |
| 170 | Sabánica | Poaceae | Paspalum plicatulum Michx. | 3 |
| 171 | Sabánica | Poaceae | Schizachyrium sp. | 3 |
| 172 | Sabánica | Poaceae | Setaria sp.1 | 2 |
| 173 | Sabánica | Poaceae | Setaria sp.2 | 3 |
| 174 | Sabánica | Poaceae | Tristachya leiostachya Nees | 1 |
| 175 | Sabánica | Polygalaceae | Polygala sp. | 1 |
| 176 | Sabánica | Primulaceae | Myrsine sp. | 2 |
| 177 | Sabánica | Rubiaceae | Cordiera humilis (K. Schum.) Kuntze | 6 |
| 178 | Sabánica | Rubiaceae | Mitracarpus sp. | 2 |
| 179 | Sabánica | Rubiaceae | Richardia sp. | 1 |
| 180 | Sabánica | Rubiaceae | Tocoyena formosa (Cham. & Schltdl.) K. Schum. | 4 |
| 181 | Sabánica | Rutaceae | Zanthoxylum rhoifolium Lam. | 1 |
| 182 | Sabánica | Rutaceae | Zanthoxylum sp. | 3 |
| 183 | Sabánica | Sapindaceae | Cardiospermum pterocarpum Radlk. | 2 |
| 184 | Sabánica | Sapindaceae | Serjania erecta Radlk. | 2 |
| 185 | Sabánica | Sapotaceae | Pradosia brevipes (Pierre) T.D. Penn. | 7 |
| 186 | Sabánica | Smilacaceae | Smilax sp. | 1 |
| 187 | Sabánica | Xyridaceae | Xyris sp. | 1 |
Los transectos utilizados para el muestreo proporcionaron números variables en la riqueza de especies, como se muestra en los rangos intercuartiles (Figura 2). En la formación forestal, el promedio riqueza de especies obtenida fue igual a 23,4, con una variación de 10 a 48 especies. No obstante, fue más consistente en los transectos de la formación sabánica, con un promedio de 18,1 especies, donde la riqueza de las especies no difería más de 15 especies entre las transectos.
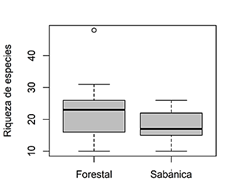
Figura 2 Diagrama de cajas de la riqueza de especies encontrada en cada uno de los transectos en las formaciones vegetales.
Según las curvas de acumulaciones resultantes, la riqueza de especies de plantas nativas para ambas formaciones vegetales al final del muestreo no llegó a su asíntota, lo que sugiere que la riqueza de especies está subestimada (Figura 3). De hecho, la efectividad del muestreo, comparada con la riqueza de especies esperada según el estimador Chao II, fue sólo del 60,9% para la formación forestal y 56,55% para la formación sabánica.
A pesar de las limitaciones arriba mencionadas, la riqueza florística detectada en este estudio fue mayor a la descrita por Céspedes y Mereles16 (150 plantas vasculares) en una evaluación previa en esta misma zona. Asimismo, estudios similares llevados a cabo en diferentes áreas de Cerrado del Brasil, se destacaron las formaciones sabánicas sobre las formaciones forestales33-36. En contrapartida, Pinheiro y Durigan37 reportaron una mayor riqueza de especies de plantas en las formaciones forestales en relación a las formaciones sabánicas, con 71 y 50 especies, respectivamente.
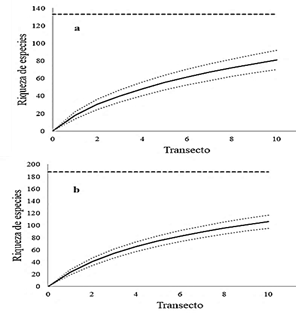
Figura 3 Curva de acumulación de especies (líneas sólidas) en función del número de transectos por cada formación vegetal: forestal (a) y sabánica (b). Los intervalos de confianza (95%) están representados por puntos discontinuos. La riqueza estimada de especies con el estimador Chao II se indican con una línea discontinua.
En las formaciones forestales (Figura 4 a, b), las familias mejor representadas fueron: Annonaceae (cuatro especies), Fabaceae (siete esp.), Rubiaceae (siete esp.), y Sapindaceae (seis esp.). Las especies más frecuentes fueron: Copaifera langsdorffii Desf. var. langsdorfii (nueve transectos) de la familia Fabaceae, Didymopanax morototoni (Aubl.) Decne. & Planch. (nueve trans.) de la familia Araliaceae, Protium heptaphyllum (Aubl.) Marchand (siete trans.) de la familia Burseraceae, y Vochysia tucanorum C. Mart. (ocho trans.) de la familia Vochysiaceae.
Las familias mejor representadas en las formaciones sabánicas (Figura 4 c, d) fueron: Arecaceae (seis esp.), Asteraceae (seis esp.), Euphorbiaceae (10 esp.), Fabaceae (19 esp.), Poaceae (19 esp.) y Rubiaceae (cuatro esp.). En cuanto a la frecuencia de las especies, resaltaron: Axonopus cfr. siccus (Nees) Kuhlm. (nueve trans.) de la familia Poaceae, Butia paraguayensis (Barb. Rodr.) L.H. Bailey (siete trans.) de la familia Arecaceae, Duguetia furfuracea (A. St.-Hil.) Benth. & Hook. f. (siete trans.) de la familia Annonaceae, Campomanesia adamantium (Cambess.) O. Berg (siete trans.) de la familia Myrtaceae, y Pradosia brevipes (Pierre) T.D. Penn. (siete trans.) de la familia Sapotaceae.

Figura 4 Formaciones vegetales del Cerrado Aguará Ñu. (a) y (b) Formaciones forestales. (c) y (d) Formaciones sabánicas.
Solamente 14 especies de plantas fueron comunes en ambas formaciones vegetales muestreadas: Arecaceae (Acrocomia aculeata (Jacq.) Lodd. ex Mart., Butia paraguayensis (Barb. Rodr.) L.H. Bailey, Syagrus romanzoffiana (Cham.) Glassman), Annonaceae (Duguetia furfuracea (A. St.-Hil.) Benth. & Hook. f.), Euphobiaceae (Croton sp.), Erythroxylaceae (Erythroxylum cuneifolium (Mart.) O.E. Schulz), Fabaceae (Acosmium subelegans (Mohlenbr.) Yakovlev, Anadenanthera peregrina (L.) Speg., Bauhinia sp.), Lauraceae (Nectandra lanceolata Nees & Mart.) Primulaceae (Myrsine sp.), Rutaceae (Zanthoxylum rhoifolium Lam.), Sapindaceae (Serjania erecta Radlk.), Smilacaceae (Smilax sp.).
La familia botánica Fabaceae fue la más importante en ambas formaciones vegetales. Esto concuerda con los reportes de varios investigadores34,36,38,39. Se destaca también que Vochysia tucanorum37, Caryocar brasiliense y Qualea grandiflora39,40 fueron algunas de las especies más comúnmente reportadas en el Cerrado de Brasil, y aunque también fueron encontradas en la presente investigación, la frecuencia de las mismas no fue significativa.
Comparando estos resultados con estudios florísticos anteriores realizados en las formaciones forestales y sabánicas del Cerrado Aguará Ñu se tiene que, de las 15 plantas vasculares descritas por Marín et al.17, sólo siete de ellas (46,7 %) han sido registradas en esta investigación. De las 26 especies de plantas vasculares reportadas por Céspedes y Mereles16, 9 (34,6 %) son comunes a este estudio. Mientras tanto, de las 106 especies descritas por Rolón et al.19, 40 (37,7%) coinciden con las especies encontradas en esta investigación.
Con base en lo reportado por Peña-Chocarro et al.18, en esta evaluación se mencionan por primera vez para la Reserva Natural del Bosque Mbaracayú y para el Departamento de Canindeyú, a Magonia pubescens A. St.-Hil., Talisia esculenta (Cambess.) Radlk., Pouteria ramiflora (Mart.) Radlk., Kielmeyera coriácea Mart. & Zucc., Stillingia salpingadenia (Müll. Arg.) Huber, Digitaria sacchariflora (Nees) Henrard, Paspalum plicatulum Michx., Axonopus cfr. siccus, Gouinia brasiliensis (S. Moore) Swallen, Heteropogon contortus (L.) P. Beauv. Ex Roem. & Schult., Oedochloa procurrens (Nees ex Trin.) C.Silva & R.P. Oliveira, Panicum bergii Arechav., y Paspalum cfr. chacoense Parodi.
La composición de especies de plantas nativas fue significativamente diferente entre ambas formaciones vegetales (ANOSIM, R = 0,997; p =0,001, Fig. 5a), ya que el stress de la figura de los ejes del nMDS proporcionaron una buena representación bidimensional de los transectos según su composición de especies y fue igual a 0,072. Además, no se evidenció superposición entre los transectos, a pesar de una dispersión más pronunciada de los transectos de la formación sabánica (ANOSIM, R = 0,997; p =0,001, Figura 5b). Esto implica que, aunque hubo una consistencia en la riqueza de especies en la formación sabánica, la composición de especies varió significativamente entre cada transecto.
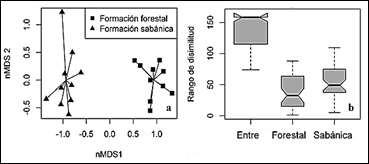
Figura 5 Patrones de composición de especies. (a) Ejes de ordenación de la nMDS. El stress de la figura es de 0,072. Las líneas negras que unen los puntos representan la distancia entre cada transecto y el centroide de su respectiva formación vegetal en el espacio bidimensional. (b) Diagramas de cajas que indican los rangos de disimilitud entre y dentro de cada formación vegetal.
A partir de la comparación de composición de especies hecha en este análisis, se corrobora la disimilitud florística típica entre las formaciones forestales y sabánicas del Cerrado en el área de estudio3,36, derivada de la combinación de la estacionalidad de las lluvias, las condiciones del suelo, el régimen del fuego y el factor de tolerancia a la sombra de las plantas3,41-44, lo que sugiere un buen estado de conservación del área protegida. No obstante, debido al tipo de evaluación que se realizó, y dado que los indicadores analizados no se contrastaron con factores como la frecuencia de la perturbación ocasionada por el fuego y la presencia de plantas exóticas con potencial de invasión observadas, se recomienda monitorear de forma continua el área, y establecer investigaciones que exploren estos elementos, de manera a avanzar hacia una mejor comprensión de la dinámica vegetacional local y una mejor valoración de su biodiversidad.
4. CONCLUSIÓN
Existe una clara diferenciación florística entre las formaciones forestal y sabánica del Cerrado Aguará Ñu; la riqueza de especies es mayor en esta última, y solamente comparten 14 especies de plantas nativas de las 171 encontradas en el estudio. No obstante, ambas formaciones vegetales tienen en común la importancia de la familia Fabaceae dentro de su composición florística.
Dadas las características y limitaciones de la evaluación ecológica rápida realizada, se recomienda seguir monitoreando el área desde diferentes aristas para una mejor valoración de su estado de conservación.












 uBio
uBio 


