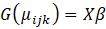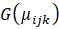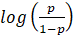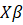INTRODUCCIÓN
En época prehispánica, la región andina del noroeste argentino fue una zona tradicional de cultivo de quinua (Chenopodium quinoa Willd). En Jujuy, Argentina, su cultivo se localizó en valles intermontanos de la Puna, pero tras la colonización española, el cultivo fue rechazado por considerarse “comida india”, quedando restringido en las huertas familiares para el autoconsumo. En los últimos 20 años, sin embargo, su consumo se ha expandido a nivel regional y mundial, y su valor nutricional y capacidad de adaptación a diferentes regiones geográficas han sido reconocidas. En el año 2011, fue declarado por la FAO como cultivo estratégico para la seguridad y soberanía alimentaria global (Alandia, Rodriguez, Jacobsen, Bazile y Condori, 2020; Bazile; Biaggi y Jara, 2021). La Asamblea General de las Naciones Unidas propuso la declaración de “Año Internacional de la Quinua” (IYQ) al 2013, otorgando el estatus de “cultivo con potencial de crecimiento en la agricultura mundial” (Ruiz et al., 2016). Así, el número de países productores de quinua que en 1980 era de tan solo ocho, en 2014 ascendió a 75, y en 2015 se extendió a casi un centenar de países (Bazile y Baudron , 2015).
La planta de quinua, es afectada por factores bióticos y abióticos. Colque-Little, Amby y Andreasen (2021), señalan que el viaje de la quinua a ambientes desconocidos, aumenta el riesgo de observar enfermedades nuevas y emergentes. Sin embargo, en todas las zonas andinas y aquellas donde ésta fue introducida, el Mildiu (Peronospora variabilis Gaum) se reconoce como el principal problema sanitario por la complejidad para el control y los altos niveles de prevalencia, incidencia y/o severidad (Thines y Choi, 2016; Khalifa y Thabet, 2018; Kara et al., 2020).
El control microbiológico mediante hongos antagonistas representa una alternativa sostenible. En este sentido las especies del género Trichoderma son las más estudiadas (Bae et al., 2009; Hanson y Howell, 2004). Este hongo pertenece a la clase Ascomicetes, orden Hypocreales, familia Hypocreaceae, y se encuentra naturalmente como habitante del suelo (Samuels y Hebbar, 2015). La facilidad para su aislamiento y cultivo in vitro, capacidad para colonizar sustratos naturales y artificiales, y adaptabilidad a distintos sistemas ecológicos, potencian el interés de su estudio para el control biológico de patógenos, a lo que se suman otras aplicaciones biotecnológicas (Martínez, Infante y Reyes, 2013; Samuels y Hebbar, 2015). La asociación de Trichoderma con una planta huésped ha dado lugar a múltiples beneficios, que van desde el aumento de la biomasa y el crecimiento de las plantas hasta la tolerancia al estrés biótico-abiótico y la absorción de nutrientes (Potshangbam, Devi, Sahoo y Strobel, 2017; Carrero-Carrón et al., 2018).
El término "Endophyte" se refiere a organismos que residen dentro de los tejidos vegetales, excluyendo epífitas que viven en la superficie de las plantas (Li et al., 2015; Chitnis et al., 2020; Delgado, Ortega, Martínez y Coca, 2021). Sun y Guo (2012) señalan que los endófitos mutualistas son aquellos que colonizan hojas, tallos, ramas y raíces sin causar síntomas de enfermedad. A pesar de que los hongos endófitos se pueden aislar con facilidad, muchos son específicos de un cultivo. La interacción física entre Trichoderma y los tejidos de una planta fue observada por Yedidia, Benhamou & Chet (1999) quienes, mediante microscopía electrónica, reconocieron estructuras del hongo en capas de células de la epidermis vegetal y la corteza exterior de la raíz. Leon Ttacca, Ortiz Calcina, Condori Ticona y Chura Yupanqui (2018), evaluaron la colonización endófita de 10 cepas de Trichoderma en plántulas de quinua, señalando que todas lograron colonizar diferentes partes de la planta, aunque con diferencias en cuanto a la eficiencia.
Este trabajo tuvo como objetivo evaluar tres cepas de Trichoderma asperelloides aisladas de suelos de Quebrada y Puna Jujeña, Argentina, en cuanto a la capacidad de colonizar de manera endófita plántulas de tres genotipos de quinua.
MATERIALES Y MÉTODOS
Se seleccionaron tres cepas locales, en base a ensayos de antagonismo in vitro frente a hongos fitopatógenos (Sivila, Alvarez, Catacata y Bonillo, 2017). Las cepas se caracterizaron morfológica y molecularmente, quedando registrados en la base de datos NCBI, GenBank (https://www.ncbi.nlm.nih.gov/genbank/; Alvarez, Benítez Ahrendts y Yasem, 2023).
Cepas seleccionadas:
T1: T. asperelloides (Álvarez et al., 2019 N° LF1- MK635495) S 22° 29' 42,35", O 65° 22' 45,30", 3945 msnm;
T15: T. asperelloides (Álvarez et al., 2019 N° LF4-MK635497) S 22° 29' 42,90", O 65° 22' 51,06", 3934 msnm y
T16: T. asperelloides (Álvarez et al., 2019 N° LF5-MK635498) S 23°51′10″, -O 65°27′58″, 2099 msnm.
Se trabajó con tres genotipos de quinua: AMMA-18, RQ-SAC-18 y RQ-252-18, conservados ex situ en el banco de germoplasma del Instituto Nacional de Tecnología Agrícola-Salta, e in situ en la Estación Experimental Agrícola Abra Pampa-Jujuy, cedidas en el marco de un acuerdo de transferencia de materiales para estudio.
Los bioensayos se realizaron en el invernadero y laboratorio de Innovación y Validación de Tecnologías Agroecológicas (LIVTA) dependiente del Centro de Estudios para el Desarrollo de la Agricultura Familiar (CEDAF), emplazados en el campo experimental de la Facultad de Ciencias Agrarias de la Universidad Nacional de Jujuy, Argentina (24°21’06,29’’S; 65°11’29,21’’O; 1071msnm).
Se aplicó un diseño factorial que incluyó los factores de efectos fijos a) genotipo de quinua: AMMA-18, RQ-252-18, y RQ-SAC-18; b) cepa de T. asperelloides: T1, T15, T16, Testigo; c) órgano de la planta: raíz, tallo, hoja, y d) momento de evaluación: 15 y 30 días después de la aplicación del hongo (dda), con 5 réplicas. La colonización endófita se evaluó a través de la variable dicotómica dependiente: ocurrencia o no ocurrencia del re-aislamiento del hongo.
Cada genotipo de quinua se sembró en bandejas almacigueras de 49 alveolos utilizando sustrato estéril (esterilizado en autoclave durante 1 hora a 120°C). A las 48 h, en cada alveolo se aplicó 5 cm3 de suspensiones de 106 conidios cm-3 de cada cepa, utilizando agua estéril para el testigo. Las bandejas se mantuvieron a temperatura ambiente para el posterior muestreo a los 15 y a 30 dda. En cada caso se tomaron al azar veinte plántulas de cada genotipo/cepa y del testigo (cinco repeticiones de cuatro plántulas cada una). La unidad experimental fue cada planta de quinua.
En el laboratorio, las plántulas se lavaron con agua para eliminar los restos de sustrato. En la cámara de flujo laminar, se realizó la desinfección superficial de las mismas mediante su inmersión en alcohol etílico (70%) durante 2 minutos y cinco enjuagues sucesivos con agua destilada estéril. Las plántulas permanecieron en la cámara hasta la evaporación del exceso de humedad (Figura 1). Para la siembra en medio de cultivo se cortaron secciones de raíz, tallo y hoja de cada planta, las que se transfirieron a cajas de Petri con Agar Agua (1,5%). Los cultivos permanecieron durante 10 días en una estufa a 24°C con un fotoperiodo de 12 h. Posterior a este tiempo, se observó cada caja para la identificación de colonias típicas del hongo alrededor de los tejidos; se realizaron montajes en Hidróxido de Potasio (KOH) al 3% (acuoso) para su observación microscópica y verificación de las características micromorfológicas de las cepas (tipo de ramificación de conidióforos, disposición, forma y dimensión de fiálides, forma y tamaño de conidios). Se utilizó un microscopio binocular Marca EAKINS acoplado a una cámara digital genérica de 51mp. Finalmente se registró la ocurrencia o no ocurrencia de re-aislamientos del hongo según genotipo, cepa y origen de las secciones en ambos periodos de muestreos (15 y 30 dda).
Luego de los 30 dda se preservaron plántulas en el fijador FAA (formol 5%, alcohol 90% y ácido acético) para estudios histológicos. Al momento de realizar los cortes, se extrajeron las muestras del fijador y se lavaron con agua estéril, las secciones se insertaron en cubos de tubérculos de papa (0.5 cm de lado) para facilitar la manipulación y realización de cortes con el micrótomo de congelación. Los cortes se recibieron en agua con glicerina, procediendo a la tinción con Astra Blue y Fucsina básica para su montaje; se utilizó el equipo óptico descripto anteriormente.
El análisis estadístico incluyó estimaciones de ANAVA (con ajuste chi-cuadrado) para un modelo logístico a los 15 y 30 dda, y prueba de comparaciones de a pares para las estimaciones “logit”, con el paquete estadístico “emmeans” del software “R”.
Para el análisis estadístico se ajustó un modelo de regresión logística para modelar la probabilidad de re-asilamiento (1) o no re-aislamiento (0) de las cepas de Trichoderma a los 15 y a los 30 dda, seleccionando el mejor modelo con el enfoque de pruebas de hipótesis:
Donde:
es la función logística , donde p es la probabilidad de éxito de reaislamiento de Trichoderma de la i-ésima observación, para i = 1, 2, …, 1080 (por remoción de las observaciones testigo).
es el conjunto de valores observados de las variables predictoras o “matriz de diseño” multiplicado por un vector de coeficientes asociados a los cofactores o variables predictoras:
β0: es el intercepto o valor esperado de la combinación de factores de referencia para G (mu).
βj: es el efecto fijo del j-ésimo nivel del factor “Genotipo”, para j = “RQ-SAC-18”, “AMMA-18” y “RQ-252-18”.
βk: es el efecto fijo del k-ésimo nivel del factor “Cepa”, para k = “T1”, “T 15” y “T 16”.
βl: es el efecto fijo del l-ésimo nivel del factor “Órgano”, para l = “Raíz”, “Tallo” y “Hoja”.
βj: βk: interacción de los niveles j y k de la “Genotipo” y el “Cepa”.
βj: βl: interacción de los niveles j y l de la “Genotipo” y el “Órgano”.
βk: βl: interacción de los niveles j y k del “Cepa” y el “Órgano”.
RESULTADOS Y DISCUSIÓN
Los resultados permitieron confirmar la colonización endófita de las tres cepas de T. asperelloides en distintos órganos de los genotipos de quinua evaluados.
El análisis exploratorio ilustrado en la Figura 2, representa la distribución de los casos re-aislamientos (1) y no re-aislamientos (2), donde los puntos del mismo color son las plantas de un mismo genotipo, inoculadas con una cepa.
A los 15 dda se observa una ocurrencia superior de re-aislamiento desde los distintos órganos de AMMA-18 y RQ-252-18 para las tres cepas de T. asperelloides durante el primer período de evaluación a los 15 dda, destacándose la cepa T16 por la frecuencia de recuperación desde raíz, tallo y hoja en el genotipo RQ-252-18; seguido de las cepas T16 y T1 en raíz y en menor medida en hojas en AMMA-18, y una menor recuperación de las tres cepas en RQ-SAC-18.
Durante el segundo período evaluado (30 dda), se registró una disminución en la ocurrencia de re-aislamientos desde RQ-252-18 en hojas y tallos. En cuanto a RQ-SAC-18 la ocurrencia de re-aislamiento a partir de secciones de raíz fue mayor que a los 15 dda para la cepa T 16. En ningún caso hubo crecimiento de colonias de T. asperelloides en las cajas testigo.
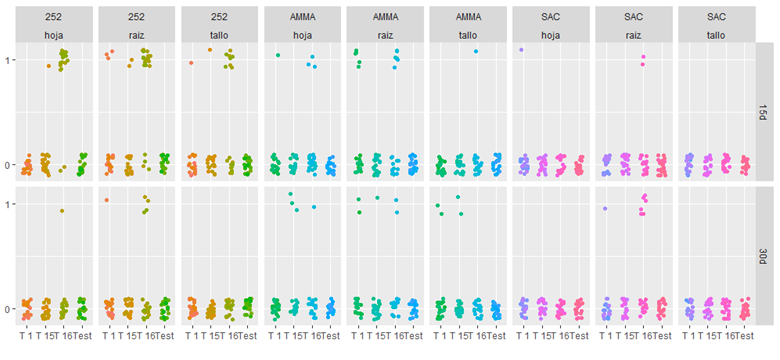
Figura 2 (1) Ocurrencia de re-aislamiento, (0) No Ocurrencia de re-aislamientos en cultivos de secciones de hoja, raíz, tallo de plántulas para cada genotipo de quinua (AMMA=AMMA-18, SAC=RQSAC-18, 252=RQ-252-18). Sección superior: evaluación a los 15dda (15d); sección inferior: evaluación a los 30dda (30d)
El Análisis de la Varianza aplicado al modelo logístico mostró que la interacción Genotipo-Cepa fue altamente significativa a los 15 dda (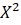 =18,4; 4 g.l.; p-valor <0,01), destacando el contraste de los valores predichos de la función logit entre las cepas T16 y T15 dentro de la población RQ-252-18, altamente significativo (p-valor < 0,001). A los 30 dda, el modelo logístico no detectó efectos significativos en factores de primer orden ni en interacciones dobles. Cuando plantearon contrastes marginales de a pares de los factores de primer orden, se observaron significativamente diferentes entre los niveles del factor órgano (p-valor<0,01), destacando el re-aislamiento en raíz.
=18,4; 4 g.l.; p-valor <0,01), destacando el contraste de los valores predichos de la función logit entre las cepas T16 y T15 dentro de la población RQ-252-18, altamente significativo (p-valor < 0,001). A los 30 dda, el modelo logístico no detectó efectos significativos en factores de primer orden ni en interacciones dobles. Cuando plantearon contrastes marginales de a pares de los factores de primer orden, se observaron significativamente diferentes entre los niveles del factor órgano (p-valor<0,01), destacando el re-aislamiento en raíz.
Los resultados de colonización endofítica de cepas de Trichoderma concuerdan con los obtenidos por León Ttacca et al. (2018), quienes verificaron la colonización de las diez cepas de Trichoderma en diferentes partes de plántulas de quinua, aunque no con la misma eficiencia. En plantas de poroto, González-Marquetti et al. (2019) verificaron el endofitismo de tres cepas de Trichoderma asperellum, y por su parte, Bailey et al. (2008) en plantas de cacao, obtuvieron diferencias en la eficiencia de colonización de acuerdo al tipo de órgano de la planta (raíces, cotiledones, tallos, plúmula, xilema). Sin embargo, Morel et al. (2021) solo pudo demostrar la colonización de veinte de las veinticinco cepas evaluadas de Trichoderma sp en tejidos radiculares de plantas de tomate.
En cuanto a la recuperación del hongo en distintos momentos desde la aplicación, los resultados fueron semejantes a los de Bailey et al. (2008), quienes comprobaron que la frecuencia de recuperación del hongo disminuía en función al incremento de los días después de la aplicación en plántulas de cacao. Sin embargo, León Ttacca et al., (2018) observaron una mayor frecuencia de re-aislamiento a los 60 días en relación al primer período evaluado de 30 dda. Bailey et al. (2008) proponen que la disminución registrada en la recuperación del hongo con el paso del tiempo se explicaría por el hecho de que los puntos de crecimiento vegetal limitarían el avance de la colonización del hongo, y así, que el nuevo tejido sea colonizado. Esta hipótesis debe probarse, considerando el cultivo a partir de secciones de tejidos de la misma edad y su contraste con secciones de tejido más juvenil y/o maduro.
La Figura 3 presenta imágenes de las cajas de cultivo al momento de la observación, con el crecimiento del hongo a partir de secciones de plántula de quinua. Cabe señalar que no se añadieron antibióticos al medio de cultivo por lo que también se desarrollaron colonias de bacterias, lo cual no limitó la observación y registro de resultados.
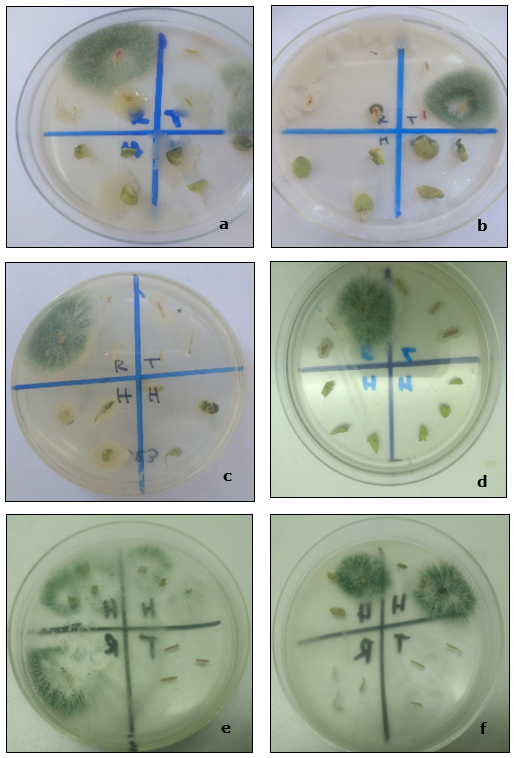
Figura 3 Ocurrencia de re-aislamientos de T. asperelloides a partir de secciones de: (a) raíz y tallo; (b) tallo; (c) y (d) de raíz; (e) raíz y hojas y (f) de hojas.
La observación microscópica de cortes histológicos permitió verificar la colonización endófita en tejidos del córtex del cuello-tallo y raíz (Figura 4). No se observaron estructuras del hongo en los cortes de hojas, y dado que hubo registro de re-aislamientos del hongo desde secciones de hojas, aunque en menor frecuencia, se sugiere incrementar el número de cortes y observaciones a futuro. Bailey et al. (2008) comprobaron la colonización de aislados de Trichoderma en raíces maduras, tallos, y cotiledones en plantas de cacao. En coincidencia con lo aquí observado, los autores registraron que las hojas estaban menos colonizadas por ciertas cepas. Sin embargo, estos autores comprobaron que algunas cepas colonizan el xilema de plantas de cacao, situación no observada en el presente trabajo. Alonso-Ramirez et al. (2014) sostienen que, durante el proceso de colonización de raíces, el ácido salicílico restringe el crecimiento de Trichoderma al apoplasto (espacio extracelular formado por paredes celulares y espacios entre las células por las que circulan el agua y los solutos), impidiendo así su llegada al sistema vascular, esta hipótesis explicaría el hecho de que las hifas no hayan colonizado los tejidos de conducción de las plántulas de quinua.
A pesar que los miembros del complejo T. asperellum raramente se han reportados como endófitos, se han citado cepas de T. asperellum y T. asperelloides en cacao y café. Tanto T. asperellum (Bailey et al., 2008) como T. asperelloides (Yedidia et al., 2003) establecieron relaciones endófitas con raíces, tallos, cotiledones y hojas de plantas, induciendo resistencia sistémica a hongos fitopatógenos y bacterias, respectivamente. Los resultados obtenidos en el presente estudio amplían los registros de cepas de T. asperelloides como endófito de quinua.
Figura 4 (a) Corte transversal del tallo a la altura del cuello (10X); (b), (c) y (d). Colonización endófita de tejidos del córtex (40X) a los 30 días; (e). Corte longitudinal de raíz, donde se observa un vaso sin presencia de hifas (40X); (f) Corte transversal de raíz, conjunto de vasos sin presencia de hifas(40X).
CONCLUSIÓN
Se verificó la colonización endófita en plántulas de quinua de tres cepas de T. asperelloides, resultando la interacción de la cepa T16 y el genotipo RQ-252-18 la combinación con mayor frecuencia de re-aislamiento a partir de secciones de raíz. Este trabajo amplió los registros existentes para T. asperelloides como endófito de quinua y los resultados presentados aquí sugieren que la colonización de quinua por las cepas evaluadas depende del tiempo transcurrido desde la aplicación y de la relación inter-específica entre el genotipo y la cepa. La selección de la cepa T16, por mayor eficiencia en la colonización endofítica en términos generales, permitirá avanzar en estudios de antagonismo y/o efecto en la promoción de crecimiento; con posibilidad de innovaciones biotecnológica como el desarrollo de bioinsumos que aporten al manejo sostenible del cultivo de la quinua.