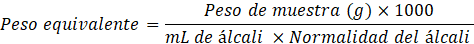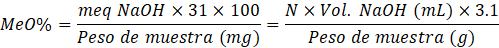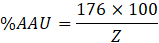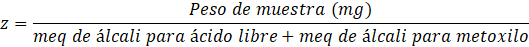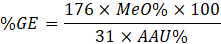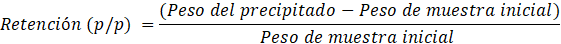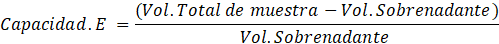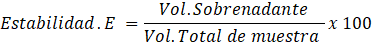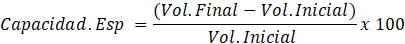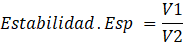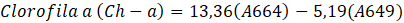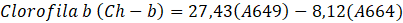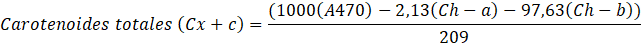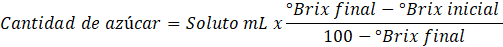INTRODUCCIÓN
En los últimos años, el aprovechamiento sostenible de los recursos naturales se ha convertido en una prioridad en distintas regiones del mundo. En este contexto, el Mango Serrano (Mangifera indica L.), también conocido como mango común, ha sido considerado una materia prima importante y valiosa (Hancco y Gabriel, 2020). Esta variedad de mango, caracterizada por su tamaño pequeño, poca jugosidad y textura fibrosa, ha sido relegada principalmente a usos artesanales debido a su menor preferencia por los consumidores. En el Perú, la mayoría de los cultivos de mango se concentran en las zonas costeras, mientras que, en la región de Huánuco, entre otras zonas de la sierra, representa solo un pequeño porcentaje de la actividad agrícola (Reaño arcila y Rimarachín Vásquez, 2015).
Aunque la industrialización del mango ha dado lugar a diversos productos comestibles, como néctares y jugos, aún hay un importante desperdicio de la cáscara de esta fruta, lo que representa un desafío ambiental (Montenegro y Vigo, 2020). Sin embargo, la cáscara del mango contiene pectina (San Martín-Hernández, Pérez-Rubio, Muy-Rangel, Vargas-Ortiz y Quintana-Obregón, 2020), un polisacárido con propiedades bioactivas y reológicas, lo que ha impulsado la investigación sobre su aplicación en la industria alimentaria (Soncco, Rodriguez y Quispe, 2022). Por otro lado, el Quito Quito (Solanum quitoense Lam), una fruta con sabor exótico y atractivo, también muestra potencial para la elaboración de néctares, jugos y mermeladas. Aunque es valorado en la provincia de Oxapampa (PE) y cultivado en varios países, su comercialización en el mercado regional ha sido deficiente debido a la falta de enfoque de los agricultores en este producto (Korese, Achaglinkame y Adzitey, 2022).
Ante lo expuesto, surgió la presente investigación que propuso desarrollar una formulación promisoria de néctar de Quito Quito y Mango Serrano, usando como aditivo alimentario, la pectina extraída de la misma cáscara de los mangos, al cual se le evaluó características fisicoquímicas, bioactivas y proximales; y en el néctar mejor aceptado se evaluó propiedades físicas para demostrar la influencia funcional de la pectina extraída. De esta manera se buscó aprovechar y dar un valor agregado a estas materias primas poco industrializadas, así como la reducción de desechos orgánicos.
MATERIALES Y MÉTODOS
La investigación se realizó en los laboratorios de Físico - Químico, Laboratorio de análisis por Instrumentación, Laboratorio de Procesos Alimentarios y el Laboratorio de Análisis Sensorial de la Escuela Profesional de Ingeniería Agroindustrial de la Universidad Nacional Hermilio Valdizán de Huánuco-Perú.
Evaluaciones fisicoquímicas de Mango Serrano. Los mangos serranos (Mangifera indica L.) analizados fueron obtenidos del mercado central de la ciudad de Huánuco, provincia de Huánuco, los cuales fueron acondicionados para los análisis de pH por el método potenciométrico (Lizama Q., 2012); sólidos solubles por el método refractométrico (Muñoz Puntes, Rubio y Cabeza, 2012); acidez titulable expresado como ácido cítrico (Paitan-Anticona et al., 2022); índice de madurez en relación con los sólidos solubles sobre la acidez (Morales-Erazo, González-Cárdenas, Abella-Gamba y Ahumada-Forigua, 2019); los porcentajes de humedad y cenizas como parámetros proximales (González-Tenorio, Totosaus, Caro y Mateo, 2013); en el análisis estadístico se aplicó la prueba de Tukey (p< 0,05), siendo los análisis por triplicado.
Extracción de pectina de Mango Serrano. Se usó el método de extracción acuosa (Prieto et al., 2017), para lo cual se desinfectaron los mangos con una solución de hipoclorito de sodio (NaClO) a 100 ppm (10 minutos). Posteriormente, se peló y trozó las cáscaras para el secado en el deshidratador de alimentos (EXCALIBUR, 4926TCD220FB-60) a 55 °C por 24 horas. Una vez acondicionada la muestra, se pesó 90 g de cáscaras secas y se sumergió en agua destilada en relación 1:4, se llevó a baño maría (Memmert, Schutzart) a 85 °C por 15 minutos para la inactivación de enzimas, y enseguida se licuó y filtró la mezcla para el centrifugado (Mettich, Rotina 380) a 10000 rpm por 10 minutos. Del sobrenadante, la pectina se precipitó con alcohol comercial de 96° en relación 1:3 respectivamente, esto, con ayuda de un agitador magnético (CAT, ROBAX) a una velocidad de 60 rpm, para no destruir la estructura molecular de la pectina. Seguidamente, la pectina se sometió a dos lavados con alcohol de 70°, durando 24 horas cada lavado. Luego, se expandió la pectina húmeda en bandejas de plástico (30 cm x 10 cm) y se secó con ayuda de una estufa (Ecocell, LSIS-B2V) a 50 °C por un día. Finalmente se molió la pectina seca con ayuda de un molinillo de café (BOSCH, 180WTSM6A013B).
Caracterización de pectina. Para la determinación del peso equivalente se desarrolló la metodología descrita por Pacheco-Jiménez, Basilio Heredia, Gutiérrez-Grijalva, Quintana Obregón y Muy-Rangel (2022). Se pesó 0,025 g de la pectina obtenida y se mezcló con 5 mL de etanol, seguidamente se añadieron 100 mL de agua destilada y se aplicaron gotas de indicador (rojo de fenol), para su titulación con NaOH al 0,1 N, procurando evitar una posible desesterificación, hasta que el indicador se torne color rosa (pH 7,5). El gasto se reemplazó en la siguiente ecuación:
Para la determinación de metoxilo, se empleó la solución neutralizada utilizada anteriormente, a la cual se añadieron 25 mL de NaOH al 0,25 N y se dejó en reposo por 30 minutos. Posteriormente, se añadió 25 mL de HCl al 0,25 N y nuevamente se llevó a valorar con NaOH al 0,01 N hasta que se obtenga un color rosa tenue (Pacheco-Jiménez et al., 2022). El gasto se consideró en la siguiente ecuación:
Para determinar el contenido del ácido anhidro urónico (AAU), se tomó los valores del peso equivalente y del contenido de metoxilo (Zegada Franco, 2015), se reemplazaron los datos según las siguientes ecuaciones, sabiendo que 176 es el peso molecular del AAU:
Una vez determinadas los cálculos anteriores se desglosa la ecuación para concluir el grado de esterificación (Pacheco-Jiménez, et al., 2022).
Se evaluó también la capacidad de retención de agua y aceite de oliva (Molina-Hernández, Martínez-Correa y Andrade-Mahecha, 2019). Para la retención de agua se preparó una mezcla de 125 mg de pectina de Mango Serrano con 50 mL de agua destila y para la retención de aceite oliva se utilizó la misma (10 mL) con 25 mg de pectina, ambos se mezclaron hasta homogenizar y se almacenó en oscuridad por 1 hora. Posteriormente, se centrifugaron ambas muestras por 10 minutos a 10000 rpm, y enseguida se eliminaron los sobrenadantes, y se pesó el precipitado para despejar la siguiente ecuación:
Se analizó la capacidad y estabilidad emulsionante de la pectina (Chamorro Domínguez, 2019), para lo cual, se preparó una solución al 65% p/p para 15 mL de aceite de girasol, se agitó por 5 minutos para homogenizar la pectina (1 g) en el solvente utilizado. Posteriormente, se centrifugó a 6000 rpm por 5 minutos, inmediatamente se llevó a baño maría por 30 minutos a 80°C y se dejó reposar hasta llegar a temperatura ambiente. Se volvió a centrifugar por 5 minutos a la misma revolución y se anotó los volúmenes del precipitado y la muestra total para despejar las siguientes ecuaciones:
Para la determinación de capacidad espumante y estabilidad espumante de la pectina (Molina-Hernández et al., 2019), se pesó 500 mg de pectina y se le añadió 50 mL de agua destilada, dicha muestra se homogenizó por 5 minutos para lograr la disolución de la misma. Posteriormente, se colocó en una probeta y se agitó constantemente en 3 tiempos de 5 minutos cada uno, midiendo los cm de volumen generados con adición de la espuma, al inicio y al final del patrón, los datos se despejan en las siguientes ecuaciones:
Donde:
V1: Volumen de espuma generado al agregar la muestra a la probeta y V2: Volumen de la espuma generada después de agitar la probeta.
Así también se analizaron características bioactivas en la pectina extraída, como proteínas por el método espectrofotométrico de Bradford; así también las clorofilas y carotenoides totales. En el caso de proteínas se pesó 500 mg de pectina de Mango Serrano, con ayuda de una balanza analítica (AdventurerTM OHAUS, AR2 140) en una fiola de 50 mL, posteriormente se aforó con suero fisiológico y se homogenizó la mezcla para ser centrifugado con una microcentrifuga (Mettich, Rotina 380). Se separó el sobrenadante del precipitado y se disolvió el solvente con el reactivo Bradford en relación 1:2 mL, enseguida, se incubó la muestra a 25 °C por 10 minutos, e inmediatamente se cuantificaron la absorbancias por triplicado en un espectofotómetro Uv-vis (Termofisher, OHAUS) a 595 nm. Las absorbancias se reemplazaron en la curva de calibración previamente preparada, siendo los puntos de la curva desde 100 hasta 1500 µg/mL BSAE, donde la incógnita “x” es la concentración de proteínas (Sadkaoui, 2018).
El método utilizado para hallar las clorofilas y carotenoides totales, fue descrito por Andrade-Cuvi, Guijarro-Fuertes y Luzcando Figueroa (2021). Se tomaron 0,5 g de pectina, se homogeneizó con 10 mL de etanol y se centrifugó a 10000 rpm durante 15 minutos. El sobrenadante se separó (0,5 mL) y se mezcló con 4,5 mL de etanol. La mezcla de la solución se analizó para el contenido de clorofila-a, clorofila-b y carotenoides en el espectrofotómetro Uv-vis, a las longitudes de ondas respectivas según las ecuaciones:
Como análisis proximales a la pectina extraída, se obtuvo la actividad de agua con el equipo Smart, HD-6 (Zegada Franco, 2015) , porcentaje de humedad (Serrat-Díaz, Fé-Isaac, Fé-Isaac y Montero-Cabrales, 2018), para el cual se empleó un determinador de humedad para granos y harinas (AND, MX-50) y cenizas por técnica diferencial (San Martín-Hernández et al., 2020).
Elaboración de néctar de Quito Quito con pulpa y pectina de Mango Serrano. Con un total de 7 kg de pulpa de Mango Serrano y 7 kg de pulpa de Quito Quito, ambas materias primas en estado pintón (Figura 1), se procedió a hacer las diluciones correspondientes (1:2,5) con agua, luego se procedió a estandarizar las mezclas a un pH entre 3,4 a 3,7 usando ácido cítrico, así también se reguló los °Brix, llevándolos a una unidad de 11,5. Para ello se usó la siguiente expresión:
Luego, se separó las mezclas para distribuir a tres formulaciones siendo T1 (70% Mango Serrano y 30% Quito Quito); T2 (50% Mango Serrano y 50% Quito Quito) y T3 (30% Mango Serrano y 70% Quito Quito). Todas las mezclas se pusieron a pasteurizar (85 °C por 10 minutos) y se le añadió el azúcar medido y la pectina de Mango Serrano (0,15%) como agente espesante, se embotelló los néctares y se sometieron al shock térmico para un uniforme sellado al vacío. Se almacenaron en una conservadora por 3 días para su respectivos análisis (Jesús Gutiérrez y López Zamora, 2019).
Evaluación sensorial. Se realizó con ayuda de 35 panelistas no entrenados, siendo personas completamente al azar. Los datos obtenidos fueron sometidos a análisis estadístico de varianza no paramétrico (Friedman). Los atributos que se analizaron fueron el color, mediante la comparación visual entre las muestras para detectar anomalías; el olor (aroma), percibida de sustancias volátiles mediante el olfato y comparación paliativo de la mucosa del paladar; el sabor se evaluó por separado y por cada tratamiento se limpió el paladar con 20 mL de agua aproximadamente. Cabe resaltar que para cada tratamiento se codificó con letras y números para resultados más verídicos. Para la calificación, se utilizó la prueba afectiva para determinar el grado de satisfacción presentada en la Tabla 1.
Tabla 1 Interpretación de números para calificación de aceptabilidad de néctar
| Puntaje | Calificación |
| 1 | Me disgusta muchísimo |
| 2 | Me disgusta mucho |
| 3 | Me disgusta |
| 4 | Ni me gusta ni me disgusta |
| 5 | Me gusta |
| 6 | Me gusta mucho |
| 7 | Me gusta muchísimo |
Fuente: Paucar-Menacho, Salvador-Reyes, Guillén-Sánchez y Mori-Arismendi (2016)
Evaluaciones físicas del néctar. Como parámetros físicos evaluados al mejor néctar (Grández Gil, 2012), se tomó en cuenta la determinación de viscosidad expresado en centipoise (cP) para lo cual se empleó un reómetro Brokfield- DVIII ULTRA, usando el número de Split 4; para la determinación de color con un colorímetro Lovibond, LC100/SU100.
RESULTADOS Y DISCUSIONES
En la Tabla 2, se presenta los resultados de los promedios obtenidos de la caracterización fisicoquímica de la cáscara y pulpa de Mango Serrano.
Tabla 2 Caracterización fisicoquímica de pulpa y cáscara de Mango Serrano
| Muestra | pH | SST (°Brix) | % Acidez | % Humedad | % Cenizas | Índice de madurez (IM) |
| Pulpa | 4,80 ± 0,05a | 15,57 ± 0,05a | 0,523 ± 0,01a | 76,33 ± 1,54 | 2,97± 1,73 | 29,791 ± 0,59 |
| Cáscara | 5,14 ± 0,01b | 2,30 ± 0,10b | 0,149 ± 0,01b | - | - | - |
Diferentes letras en la columna significan diferencias estadísticas (p<0,05).
En lo que concierne los resultados fisicoquímicos evaluados a la pulpa y cáscara de los mangos serranos a usar en la elaboración del néctar y la extracción de pectina, respectivamente, se obtuvieron los pH neutros de ambas muestras, así como la diferencia entre los % de acidez titulable, el cuál es un parámetro a considerar para el control de calidad y la optimización de extracción de la pectina. Los sólidos solubles considerados (°Brix) en las muestras indicaron el estado del fruto, y nos ayuda en la obtención del índice de madurez. En cuanto al porcentaje de humedad y cenizas, presentaron ligeras diferencias en comparación al mango descrito por la Cuadro Peruana de Composición de Alimentos (MINSA, 2017). En general, las características descritas perciben al mango como pintón. Se presenta en la Tabla 3 los valores resultantes de cada análisis fisicoquímico de la pectina extraída.
Tabla 3 Caracterización fisicoquímica de pectina de Mango Serrano a partir de la cáscara
| Análisis | Resultado |
| Peso equivalente | 1250 ± 240,56 |
| Contenido de metoxilo | 9,34 ± 0,25 |
| Ácido anhidro urónico | 67,11 ± 1,46 |
| Grado de esterificación | 79,01 ± 0,46 |
| % Capacidad emulsionante | 364 |
| % Estabilidad emulsionante | 21,53 |
| % Capacidad espumante | 1,35 |
| % Estabilidad espumante | 1 |
| Retención de agua (g/g) | 34,04 |
| Retención de aceite (g/g) | 19 |
| Proteínas (mg BSAE/100g) | 74,47 ± 0,96 |
| Clorofila a (µg Ch-a/g) | 2,86 ± 0,69 |
| Clorofila b (µg Ch-b/g) | 2,51 ± 0,60 |
| Carotenoides totales (µg C x+c/g) | 67,12 ± 1,82 |
| Actividad de agua (Aw) | 0,508 ± 0,006 |
| % Humedad | 9,95 ± 0,007 |
| % Cenizas | 4,87 ± 0,54 |
Se presentan las medias y desviación estándar (n=3).
Las propiedades presentes en la pectina le confieren usos como gelificante, emulsificante y estabilizante. El mecanismo de gelificación está en función del grado de metoxilación (GM). Martínez Castillo (2018), en su evaluación de pectinas cítricas de toronja (Citrus paradisi var. Star Ruby) y mandarina (Citrus reticulata blanco var. Tangerina) como agentes encapsulantes, encontró que hay pectinas con alto metoxilo (GM>60%). Para la formación de geles con pectina se necesita pH bajo cercano a 3 y alto metoxilo. La presente pectina de Mango Serrano presentó un bajo contenido de metoxilo (9,34), el cual difiere de una capacidad viscosante y emulsificantes, dando pase a su uso como agente espesante para la elaboración de diferentes productos. Sin embargo, se reportó la versatilidad que tiene la pectina respecto a sus propiedades tecnofuncionales, siendo en la mayoría de los casos distinto, de acuerdo a su origen. De acuerdo a los resultados de la pectina a base de cáscara de Mango Serrano, comparados a los valores de Barreto, Vanderlei, Vanderlei y Leite (2017), el peso equivalente (PE) de 2326,420 mg/ mEq, el MeO% de 11,801 y de ácido anhidro galacturónico 82,380 %, siendo estos resultados significativamente mayores a lo determinado. Por otro lado Mendoza-Vargas, Jiménez-Forero y Ramírez-Niño (2017) determinaron el contenido de metoxilo fue 1,58 %, PE de 5091,4 mg / meq, %GE de 72 y el %AAU de 12,5, mostrando diferencias entre los resultados. Respecto al %GE obtenido en este estudio (79,01 ± 0,46), el valor es similar a lo determinado por Pacheco-Jiménez et al. (2022) el cual fue de 77,2%. De igual manera, en el caso de la cáscara de “mango de azúcar maduro” (Barreto et al., 2017), la pectina estudiada presentó un grado de esterificación del 82%. Y por otro lado, San Martìn-Hernández et al. (2020) obtuvieron un bajo porcentaje de %GE (46,07), explicando las consecuencia de las reacciones enzimáticas (pectinasas) que hidrolizan los enlaces estéres y depolimerizan los polímeros de la pectina.
Esteban Cortina (2020), en su evaluación de las propiedades fisicoquímicas de la pectina de nopal, planteó que las propiedades buenas de las espumas están relacionadas con la estructura del mucílago, que es flexible y puede reducir la tensión superficial. La estabilidad espumante se calculó el volumen final después de 30 minutos, a pesar de que el mucílago nativo tiene baja capacidad espumante, un buen porcentaje de espuma se mantiene estable. La capacidad y estabilidad de emulsionante de 34% y 56%, respectivamente, se ven afectados por el pH más bajo, que fue de 4. Se planteó que cuanto menos hidrófoba es la estructura que tiene un compuesto, más bajo es el concentrado y mayor la tensión concluyendo que la emulsión es menos estable. En cuanto a la retención de agua, es importante analizarlo, ya que de acuerdo con los resultados, se puede inferir la utilidad y estabilidad de la pectina, que en el caso del mucílago nativo fue de 20,63 g/g, el cual tiene diferencias significativas con la pectina de Mango Serrano (34,04 g/g). También resalta la retención de aceite, que es la interacción del mismo con grupos apolares que están en la estructura química del nopal evitando la salida del aceite. El mucilago nativo tuvo un 3,2 g/g. resaltando que la esterificación aumenta esta capacidad, puesto que tiene más zonas polares a fin al agua y los disolventes que sean polares, esto puede variar a la diferenciación de materias primas diferentes y el método de extracción de pectina, siendo del autor por hidrólisis ácida en tres pH.
En el caso del bajo contenido de proteínas halladas en la pectina extraída, demostró la inhibición de enzimas en la pectina extraída, mientras que los valores de clorofila a y b encontradas, siendo 2,86 y 2,51 µg/g respectivamente, indican una casi nula impureza del producto, ya que las clorofilas son los pigmentos verdes responsables de la fotosíntesis en las plantas, el cual en la presencia de pectinas, puede significar una influencia en sus propiedades funcionales, por otro lado, demostró valores altos de carotenoides totales (67,12 µg/g), esto está directamente relacionado al índice de madurez de los mangos serranos, ya que mientras más sea la concentración de carotenoides y beta carotenos, el índice de madurez aumenta, también es considerada como una fitohormona causante de la maduración (Andrade-Cuvi et al., 2021; Britos y Vera, 2022; Flores Hernández, 2021). De acuerdo a los resultados, la actividad de agua determinada en esta investigación fue de 0,508 ± 0,006, siendo esta significativamente mayor a lo determinado por San Martìn-Hernández et al. (2020) el cual obtuvo un total de 0,39 ± 0,01 de actividad de agua. Investigaciones (Eghbal et al., 2016) aclaran que estas propiedades juegan un papel fundamental en la degradación y estabilidad producto señalando que el contenido de agua perjudicará significativamente las propiedades mecánicas y de barrera, influyendo también en la estructura y organización molecular debido a que el agua funciona como plastificante. La pectina en esta investigación presentó una humedad de 9,95% y un porcentaje de cenizas de 4,87, valor similar a lo obtenido por Pacheco-Jiménez et al. (2022) con un contenido de humedad de 10,6%, siendo significativamente diferente en el resultado de cenizas con un total de 2,4%, siendo este menor significativamente. En la Tabla 4 se presenta los resultados de la evaluación sensorial evaluadas a los 3 tratamientos de néctares de Quito Quito con Mango Serrano.
Tabla 4 Resultados de evaluación de los atributos como prueba de aceptabilidad de néctares de Quito Quito con Mango Serrano
| Atributo | T1 (70% MS+30% QQ) | T2 (50% MS+50% QQ) | T3 ( 30% MS+70% QQ) | Sig. Asíntota |
| Color | 5,5±0,82b | 5,2±0,93b | 5,9±0,84ª | 0,000 |
| Olor | 4,9±0,30b | 4,7±0,90b | 5,2±0,92ª | 0,001 |
| Sabor | 5,3±1,00b | 5,0±1,00b | 5,5±0,89ª | 0,002 |
| Textura | 5,5±0,90a | 4,7±1,10b | 5,1±1,00a | 0,003 |
Se presentan las medias y desviación estándar (n=3). Los valores de una misma fila con letras diferentes son significativos (p< 0,05). “MS” (Mango Serrano) “QQ” (Quito Quito).
En los resultados de la aceptación de los tratamientos de los néctares, el T3 tuvo los valores más altos para los atributos de color (5,9), olor (5,2) y de sabor (5,5), se observó diferencias significativas entre estos atributos (p< 0,05) y los demás tratamientos, siendo el tratamiento con puntajes más bajos el T2. Esto difiere la predominancia del Quito Quito sobre el Mango Serrano, sin embargo, en lo que se refiere el atributo de textura, el T1 resultó el más alto puntaje (5,5), la razón se explica en la misma consistencia del mango, lo que sensorialmente es más aceptado. El tratamiento que tuvo mayor aceptación fue el T3, al cual se le hizo los análisis físicos correspondientes. Por otro lado, en los resultados físicos considerados como viscosidad y parámetros de color siendo L*, a* y b* realizados al néctar mejor aceptado (T3) entre los panelistas, se presenta en la Tabla 5.
Tabla 5 Evaluaciones físicas en el néctar de Quito Quito con Mango Serrano (T3)
| Evaluación | Resultados |
| Viscosidad absoluta (cP) | 151,84 ± 3,12 |
| Parámetro L* | 33,92 ± 1,02 |
| Parámetro a* | 5,26 ± 0,26 |
| Parámetro b* | 21,76 ± 1,55 |
Se presentan las medias y desviación estándar (n=3).
En la investigación fisicoquímica de Grández Gil (2012), que elaboró néctares a diferentes concentraciones de maracuyá y mango, demostró con un reómetro, la viscosidad relativa entre 5,95 cP a 13,8 cP, encontrados en sus tratamientos, los cuales asumían que cuando se aumentaba la concentración del mango, aumentaba la viscosidad, coincidiendo así con los resultados de la preferencia sensorial de textura, donde el T1 con más concentración de mango fue el más aceptado, sin embargo los resultados del autor son muy bajos en comparación al T3 ya que este empleó una dilución con agua de hasta 3,5 con las pulpas. Otras investigaciones sugieren que la viscosidad en néctares de mango suele encontrarse en el rango de 20 a 150 centipoises (cP) a temperatura ambiente, así también sustentan que la viscosidad aumenta a medida que la temperatura baja en el néctar (Panchi Guanoluisa, 2013).
Según Andrade-Cuvi et al., (2021) menciona que el color es sinónimo de estabilidad en un néctar y se relaciona con la aceptabilidad que posee el producto por parte de los consumidores, el autor tomó las medidas según la escala CIE L*a*b*, así mismo, estas características están relacionadas a la capacidad antioxidante y los polifenoles presentes en el néctar, ya que retrasa la oxidación, dando un buen aspecto al color (Condori Macedo, 2019).
Otro estudio importante y destacable es de los autores Chilan Basurto y Garcia Farias, (2022), en el proceso de estudio de estabilidad del color en néctares de mango, fueron puestas a almacenamiento (35 °C) y posteriormente evidenciaron valores medios de 57,76 para L*, 14,55 para a* y b* de 38,61, donde L* y b* fue en el tiempo una tendencia a colores opacos, respectivamente, esto puede ser debido a la foto-degradación por el calor. En la presente investigación, la oxidación de los enlaces dobles de los carotenoides presentes en la pectina del Mango Serrano, fue responsable de la coloración amarilla, ocasionando un pardeamiento notable en los días de su almacenamiento (Silva et al., 2013).
CONCLUSIONES
Existe un uso potencial de la pectina de Mango Serrano a partir de la cáscara seca, como aditivo viscosante en la adición del néctar de Quito Quito con pulpa de Mango Serrano. Las características fisicoquímicas más resaltantes en la pectina extraída, fueron el contenido de metoxilo, el alto grado de esterificación, la gran capacidad de retención de agua y los contenidos de carotenoides totales, los cuales demuestran una buena calidad como pectina alimentaria. Por otro lado, en la elaboración de las fórmulas de los néctares, se aceptó mayoritariamente el T3 compuesto por 30% Mango Serrano y 70% Quito Quito y a lo cual se halló una relación en la influencia de la pectina y el color del néctar, así también ocurrió en la viscosidad del néctar, siendo influenciado por la concentración de pulpa de Mango Serrano.