INTRODUCCIÓN
El psílido de papa, Bactericera cockerelli (Šulc) (Hemiptera: Psyllidae) es considerada una plaga en varias especies de solanáceas, que inicialmente fue tratada como una plaga ocasional debido a que desarrollaba brotes poblacionales esporádicos, sin embargo, esta apreciación ha cambiado drásticamente en los últimos años debido a que la especie ha experimentado un cambio en su distribución, rango de plantas hospedantes y, principalmente por su capacidad para transmitir un patógenos en las plantas (Prager y Trumble, 2018). Aunque las especies de Psylloidea generalmente se alimentan de un número restringido de plantas hospedantes, B. cockerelli muestra un hábito de alimentación más generalista pudiendo alimentarse de más de 40 especies en 20 familias, incluyendo Convolvulaceae, Lamiaceae y Solanaceae, mostrando preferencia sobre especies de esta última, resaltando Capsicum annum L., Solanum tuberosum L., Solanum melongena L. y Solanum lycopersicum L., sin embargo, aún no existen acuerdo al respecto (Prager y Trumble, 2018).
Bactericera cockerelli se alimenta del floema de la planta hospedadora, lo que provoca amarillamiento caracterizado por curvatura de las hojas, clorosis, retraso del crecimiento y, en casos extremos, muerte de las plantas (Olaniyan et al., 2020). A inicios de 1990 se asoció el daño causado por B. cockerelli en solanáceas con el amarillamiento de la planta provocado por un trastorno fisiológico presumiblemente causado por una toxina transmitida durante la alimentación del insecto, especialmente en las ninfas, sin embargo, la naturaleza de esta toxina aún no se ha demostrado (Munyaneza y Henne, 2013).
Aparte de la inyección de toxinas, recientemente se demostrado la capacidad de B. cockerelli de transmitir la bacteria Candidatus Liberibacter solanacearum (sinónimo Ca. L. psyllaurous) la cual también se asocia con la enfermedad en papa Zebra chip (Liefting et al., 2009).
Con relación a su distribución geográfica, aunque se presume que el psílido de la papa tiene su centro de origen en el sudoeste de los Estados Unidos y el norte de México, actualmente está ampliamente distribuida en Norte América (Estados Unidos, México y Canadá), Centro América (Guatemala, Honduras, Nicaragua, El Salvador) y Nueva Zelandia (European and Mediterranean Plant Protection Organization, 2013). Recientemente fue reportada su presencia en Ecuador, sin embargo, no ha sido reportado en Costa Rica, Panamá y Colombia, lo que sugiere que esta plaga pudo haber sido introducida al Ecuador junto con productos agrícolas debido al intenso comercio entre países del norte de Sudamérica (Castillo Carrillo, Fu y Burckhardt, 2019).
Dado que la papa es uno de los principales cultivos tradicionales producidos en toda la sierra ecuatoriana, con una superficie sembrada de 22099 ha y un rendimiento de 121816 kg/ha durante el 2018 (Organización de las Naciones Unidas para la Alimentación y la Agricultura, 2022), la reciente introducción del psílido de la papa representa una seria amenaza para la producción de este rubro en el país. El objetivo del trabajo fue evaluar cual es la distribución de esta plaga, su potencial para causar daño en las diferentes variedades de papa cultivadas comercialmente en el país y en otras especies de solanáceas de importancia económica.
MATERIALES Y MÉTODOS
El estudio fue dividido en dos fases; la primera fase consistió en muestreos quincenales en los cantones Ambato, Píllaro, Pelileo, Quero, Mocha y Tisaleo (provincia de Tungurahua) y Salcedo (provincia de Cotopaxi), de acuerdo con la tabla 1.
Tabla 1. Zonas de muestreo de las poblaciones de B. cockerelli
| Localidad | Coordenadas | ||
|---|---|---|---|
| Provincia Cotopaxi | |||
| Cantón Salcedo | X | Y | Z |
| San Marcos | 768073 | 9883216 | 2692 |
| Papahurco | 770724 | 9883532 | 2759 |
| Chambapongo | 772309 | 9883359 | 2881 |
| Huagraguasi (finca 1) | 776117 | 9883514 | 3042 |
| Huagraguasi (finca 2) | 778450 | 9885825 | 3258 |
| Provincia Tungurahua | |||
| Cantón Píllaro | |||
| San Andrés | 774031 | 9874525 | 2886 |
| Presidente Urbina | 771980 | 9874007 | 2792 |
| Poalo | 780561 | 9879193 | 2976 |
| Marcos Espinel | 775662 | 9869474 | 2938 |
| San Miguelito | 776613 | 9867284 | 2946 |
| Cantón Ambato | |||
| Cunchibamba | 768662 | 9873651 | 2683 |
| Atahualpa | 767315 | 9865182 | 2622 |
| Izamba | 770772 | 9865147 | 2658 |
| Pilahuin | 752824 | 9855363 | 3289 |
| Martinez | 765135 | 9869189 | 2921 |
| Cantón Tisaleo | |||
| La Matriz | 759595 | 9850610 | 3223 |
| Quinchicoto | 761515 | 9846300 | 3202 |
| Cantón Mocha | |||
| Pinguili | 763007 | 9844576 | 3100 |
| Cantón Quero | |||
| Yanayacu | 759780 | 9841079 | 3355 |
| Rumipamba | 763075 | 9838940 | 3520 |
| La Matriz | 767336 | 9846551 | 3011 |
| La Matriz | 769427 | 9844926 | 3431 |
| Rumipamba | 762340 | 9841903 | 3229 |
| Cantón Pelileo | |||
| Huambaló | 775181 | 9845410 | 2945 |
Para la toma de muestras, en cada localidad las plantas fueron divididas en tres estratos: superior, medio e inferior y de cada estrato fueron tomadas 10 hojas completas y colocadas en bolsas plásticas internamente cubiertas con papel absorbente. Las muestras de hoja fueron llevadas al laboratorio de Entomología de la Facultad de Ciencias Agropecuarias, Universidad Técnica de Ambato (Temp: 21,2 ± 2 °C; H.R.: 50 ± 5% y fotoperíodo 12:12). Una vez en el laboratorio, las hojas fueron examinadas bajo aumento de un microscopio estereoscópico (marca Leica) para contabilizar el número de huevos, fases inmaduras presentes por estrato para determinar la distribución intra-planta.
Posteriormente fueron estudiados los aspectos biológicos de B. cockerelli en hojas de papa de la variedad Super Chola, usando unidades de cría, la cual consistió en un contenedor plástico al cual se le abrió un agujero en la tapa que fue cubierto con doppio velo para asegurar la circulación de aire.
Para obtener una cohorte de edad homogénea, las hembras y machos traídos de campo fueron confinados en contenedores plásticos (903,2 cm3) donde se dispuso un envase más pequeño (6,2 cm3) con agua en su interior para sujetar pequeños brotes tiernos de papa para que sirviera como sustrato de oviposición durante 24-48 horas. Transcurrido este tiempo, las hembras y machos traídos de campo fueron retirados y los huevos fueron dejados dentro de la unidad de cría para observar el tiempo de incubación (Temp: 21,2 ± 2 °C; H.R.: 50 ± 5% y fotoperíodo 12:12). Para ello, las unidades de cría fueron observados diariamente hasta observar la eclosión de los huevos usando el microscopio estereoscópico. Una vez emergida la primera ninfa (N1), estas fueron individualizadas para determinar la duración de los diferentes instares ninfales hasta la emergencia del adulto (hembra y macho).
Las hembras y machos recién emergidos fueron nuevamente colocados en nuevas unidades de cría para medir los parámetros reproductivos (número de huevos colocados durante su tiempo de vida) y de longevidad (tiempo de vida medido desde la emergencia del adulto).
Los datos fueron sometidos a análisis de varianza y los datos que resultaron significativos fueron sometidos a prueba de medias según Tukey (p< 0,05) usando el paquete estadístico Statistix Windows versión para 10.0.
RESULTADOS Y DISCUSIÓN
Distribución geográfica e intraplanta de B. cockerelli
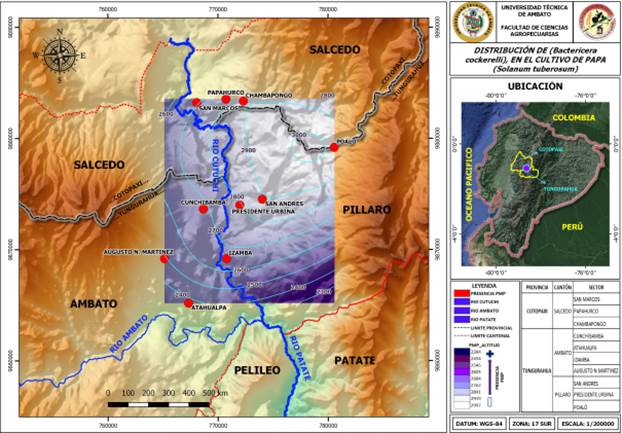
La distribución geográfica de B. cockerelli en las provincias de Tungurahua y Cotopaxi se muestra en la figura 1. Del total de cantones muestreados, B. cockerelli estuvo presente en Ambato, Píllaro y Salcedo, cuyos valores promedios fueron de 1,6; 0,66 y 0,87 ninfas/hoja y 5,62; 1,31 y 1,01 huevos/hoja, respectivamente, mientras que, en Mocha, Quero, Tisaleo y Pelileo no se encontraron especímenes asociados con cultivo de papa (Figura 2). La distribución actualmente verificada en las zonas muestreadas pareciera estar relacionada con la altura sobre el nivel del mar, puesto que la especie no fue encontrada en aquellas localidades con alturas cercanas a los 3 000 msnm. Sin embargo, hasta el presente no existe información sobre la distribución altitudinal de esta especie, por lo que deberían hacerse estudios más detallados.
Cuando se analizó la distribución geográfica de B. cockerelli en el cantón Ambato, se encontraron diferencias por efecto de la localidad (g.l.= 3; F= 28,33; P= 0.0006), siendo la densidad de la plaga significativamente superior en plantas de papa sembradas en Martínez donde el número promedio de huevos/hoja varió desde 2,43 hasta 3,63 y el número de ninfas entre 1,27 y 2,00 (Figura 3a). En las localidades de Cunchibamba, Izamba y Atahualpa el número promedio de huevos varió desde 2,11 hasta 4,16; 2,58 y 3,27 y 2,93 a 3,27, respectivamente, sin embargo, el número de ninfas fue menor (Figura 3 b-d).
De las cinco localidades muestreadas en Píllaro, el psílido de la papa fue detectado solo en Presidente Urbina, San Andrés y Poaló, mientras que en Marcos Espinel y San Miguelito, la plaga no fue encontrada. Las mayores poblaciones fueron observadas en Presidente Urbina donde la densidad de huevo varió entre 1,91 y 2,74 en los diferentes estratos de la planta, mientras que en San Andrés y Poaló estos valores oscilaron entre 1,0-3,0 y 1,58-2,44, respectivamente. En las tres localidades el número de ninfas fue siempre bajo, alcanzando un número máximo de 1,0 ninfa/hoja (Figura 4 a-c).
Por último, en el cantón Salcedo (provincia de Cotopaxi), la plaga fue reportada en tres de las cinco localidades muestreadas (San Marcos, Papahurco y Chambapongo) fue detectada la plaga, mientras que para el momento de muestreo no fue detectada en Huagraguasi. Solo en San Marco fueron verificadas las mayores poblaciones de la plaga, variando desde 2,42 a 3,38 huevos/hoja y 0,82 a 1,49 ninfas/hoja (Figura 5a), mientras que en Papahurco el número de huevos varió de 1,3 a 1,7 y el de ninfas de 0,4 a 0,7 individuos/hoja (Figura 5b). Finalmente, en Chambapongo, aunque la plaga estuvo presente, los niveles poblacionales fueron los más bajos de todas las zonas muestreadas, en donde en la mayoría de los casos alcanzó un máximo de 1,0 huevo/hoja y 0,42 ninfas/hoja (Figura 5c).
Con relación a la distribución intra-planta, la plaga no mostró un patrón de distribución espacial entre los diferentes estratos de la planta y tampoco mostró preferencia por alguna región de la hoja (Figura 6, 7 y 8).
Los resultados observados en el presente estudio son parcialmente similares a los obtenidos por Prager, Butler y Trumble (2014), quienes demostraron que tanto las ninfas como huevos de B. cockerelli mostraron preferencia por las hojas con respecto a tallos y flores y con mayor tendencia a alimentarse en la superficie abaxial, sin embargo, estos autores observaron una tendencia a que los juveniles se localicen en el estrato inferior de la planta. Contrariamente, en el presente estudio, no se observó esa misma tendencia.
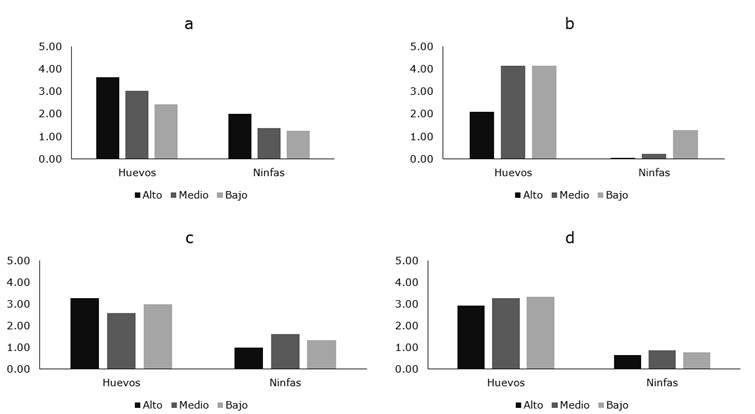
Figura 3. Distribución intra-planta de B. cockerelli en las diferentes localidades del cantón Ambato.
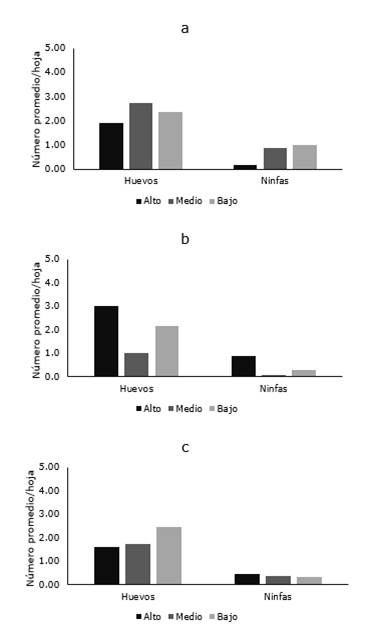
Figura 4. Distribución de B. cockerelli en las diferentes localidades Presidente Urbina, San Andrés y Poalo del cantón Píllaro.
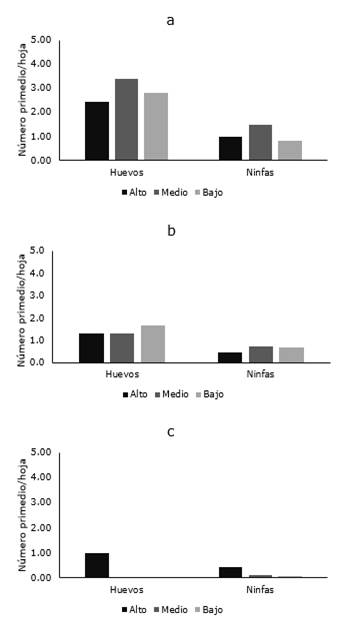
Figura 5. Distribución de B. cockerelli en las diferentes localidades San Marco, Chambapongo y Papahurco del cantón Salcedo.
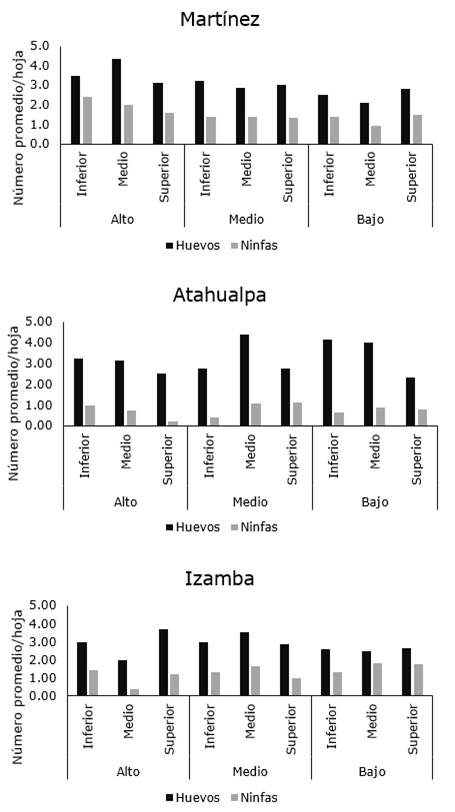
Figura 6. Distribución intraplanta de B. cockerelli en plantas de papa en localidades del cantón Ambato.
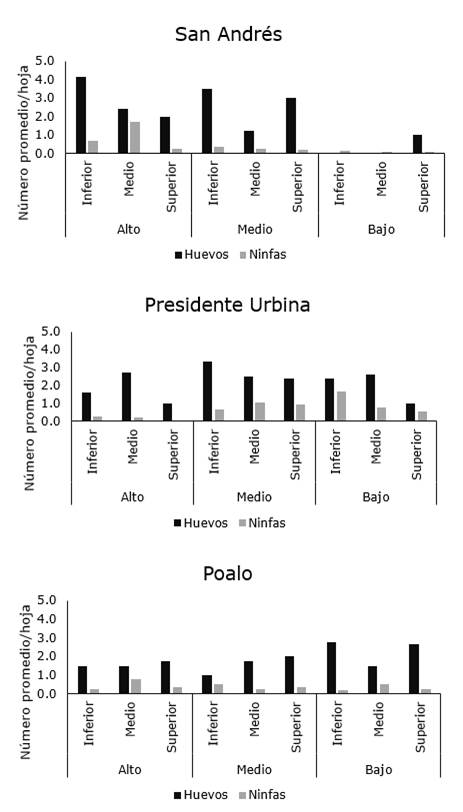
Figura 7. Distribución intraplanta de B. cockerelli en plantas de papa en localidades del cantón Píllaro.
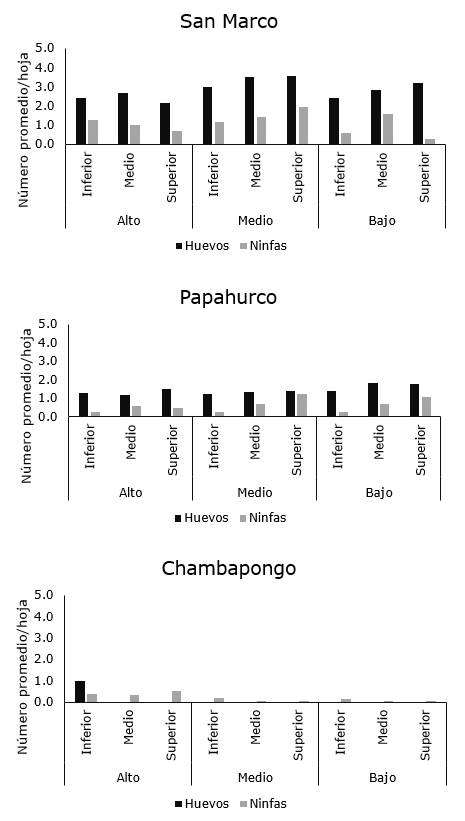
Figura 8. Distribución intraplanta de B. cockerelli en plantas de papa en localidades del cantón Píllaro.
Esta diferencia podría deberse a diferentes factores como el método de muestreo, la variedad de la planta, condiciones climáticas y a las condiciones bioecológicas de la plaga, entre otras. Con relación a este último factor, aunque Prager et al. (2014) demostraron preferencia por el estrato inferior de la planta, esto había sido diferente al inicio de su estudio cuando la plaga se localizaba con preferencia en la zona alta de la planta, lo que sugiere que esta especie presenta un tipo aleatorio de distribución, lo cual dificulta el establecimiento del muestreo para fines de control.
Similar a los resultados obtenidos en la presente investigación, Crespo-Herrera et al. (2012) también observaron diferentes patrones de disposición espacial dentro de una misma localidad, por lo que sugiere se realicen más estudios que permitan determinar si esta variabilidad en los patrones de disposición es un rasgo de la bioecología de B. cockerelli o si pudiera ser debido a otros factores tales como el tamaño de muestra usado durante el estudio o las densidades encontradas en el campo, puesto que en caso de bajas densidades de plaga, la varianza tiende a igualar a la media, lo cual denotaría un patrón de distribución pseudoaleatorio.
De acuerdo con estudios recientes, la abundancia de B. cockerelli ha mostrado tener una relación directa con la temperatura. Djaman et al. (2020) demostraron que las poblaciones del psílido de la papa aumentó cuando la temperatura promedio del aire era mayor a 19 °C durante ambas temporadas de cultivo y su abundancia mostró una mejor relación con la unidad térmica acumulada que con la temperatura promedio del aire. De manera similar, Antolínez et al. (2019) también demostraron que esta especie plaga empieza a incrementar sus poblaciones en plantaciones de papa cuando la temperatura promedio del aire es superior a 15 °C y muestra sus picos poblacionales cuando la temperatura del aire fluctúa alrededor de los 25 °C en España.
Basados en el efecto de la temperatura del ambiente sobre la densidad de la plaga, es necesario realizar monitoreos continuos en las diferentes localidades donde ha sido detectada B. cockerelli de manera de continuar evaluando el efecto tanto de los factores abióticos como de los factores bióticos sobre su distribución y variaciones poblacionales en la zona de manera de establecer medidas de control eficientes de la plaga.
Duración del ciclo biológico de B. cockerelli
El ciclo biológico de B. cockerelli estudiado a 21,2 °C y 49,6 % de humedad relativa resultó en una duración total promedio de 22,93 días cuando fue criado en plantas de papa variedad Super Chola (Tabla 2). Durante el estudio, la mayor tasa de mortalidad fue observada en la fase de huevo con un 59,6 %, mientras que en el primer y cuarto instar ninfal se verificó apenas un 4,25 %, respectivamente.
Tabla 2. Duración promedio (días ± desviación estándar) de B. cockerelli criado en plantas de papa variedad Super Chola.
| Estadio de desarrollo | Duración promedio ± D.E. | Valor mínimo | Valor máximo | Tasa de mortalidad (%) |
|---|---|---|---|---|
| Huevo | 8,21 ± 0,801 | 7 | 10 | 59,6 |
| Ninfa (total) | 14,71 ± 2,494 | 11 | 19 | |
| Primer instar | 4,29 ± 0,726 | 3 | 5 | 4,25 |
| Segundo instar | 2,14 ± 1,460 | 1 | 4 | 0,00 |
| Tercer instar | 3,71 ± 0,994 | 2 | 5 | 0,00 |
| Cuarto instar | 2,64 ± 8,871 | 1 | 5 | 4,25 |
| Quinto instar | 2,50 ± 1,286 | 1 | 4 | 0,00 |
| Total (huevo-adulto) | 22,93 ± 3,025 | 19,0 | 29,0 |
Los resultados son similares a los obtenidos por Yang, Zhang, Hua y Liu (2010), quienes observaron valores del tiempo de duración total de 22,4 días a 22,8 °C cuando fue criado en plantas de papa, con duración de las diferentes fases de desarrollo en 6,5; 3,6; 3,6; 3,1; 3,0 y 2,9 días para huevo, primer, segundo, tercer, cuarto, quinto instar ninfal, respectivamente. Por otra parte, en comparación con la duración observada en otras especies de solanáceas, los valores fueron significativamente mayores en berenjena y pimiento donde el tiempo promedio del ciclo huevo-adulto fue de 24,1 y 26,2 días, respectivamente, en las cuales se observó que el estadio de desarrollo que más tardó fue la fase de ninfa, que representó el 79,3 y 71,1 % del ciclo total en ambos cultivos (Yang y Liu, 2009).
CONCLUSIÓN
Con relación a la distribución geográfica, en la provincia de Tungurahua, la plaga fue detectada en los cantones Ambato y Píllaro, en donde fue encontrado en 7 de 14 localidades muestreadas, lo que representa el 50,0% de las zonas consideradas en el muestreo. En el caso del cantón Salcedo (Cotopaxi), fue encontrada en tres de las cinco localidades de muestreo, representando un 60% de casos positivos para la presencia de la plaga.
Con relación a la distribución intra-planta, se observó amplia variabilidad en la distribución espacial en los diferentes estratos de la planta (superior, medio e inferior), lo cual sugiere que la plaga no muestra preferencia para seleccionar el sustrato para la oviposición y que la ninfa es capaz de alimentarse de cualquier hoja, independiente de su madurez. Sin embargo, si se observó preferencia por ovipositar y alimentarse en la superficie abaxial de la hoja, lo cual debería ser considerado al momento de aplicar alguna medida de control químico.
El ciclo biológico de B. cockerelli en papa variedad Super Chola duró 22,93 días en promedio, con la mayor tasa de mortalidad durante la fase de huevo, mientras que las fases de ninfa, la tasa de mortalidad fue baja.