Introducción
El estudio de la micocenosis de las semillas de cereales es relevante para resolver problemas relacionados con la elaboración de productos agrícolas saludables y respetuosos con el medio ambiente. La enfermedad en semillas conocida como Punta negra o Black point, en inglés, es causada por un complejo de hongos, entre ellos se encuentran Alternaria y Bipolaris, géneros fúngicos que muestran una alta frecuencia de aparición en las semillas de trigo. Esta enfermedad se caracteriza por una decoloración marrón-negra en el extremo del embrión del grano según Khlebova et al. (2019).
Desde el inicio del siglo XX, se han realizado trabajos para describir y estudiar las causas de la emergencia de la punta negra en todas las regiones en donde el trigo se cultiva; estos lugares incluyen Italia, Egipto, Marruecos, Argentina, India, Canada, Estados Unidos, Alemania, África del Norte y Rusia, según Khlebova et al. (2019). Si bien la enfermedad no suele reducir el rendimiento del cultivo, la presencia de la punta negra en el grano cosechado puede disminuir la categoría y la calidad, lo que resulta en descuentos por parte del elevador. Los granos afectados son considerados como dañados según las normas de granos de Estados Unidos y se permite solo un 2%, en el trigo clasificado como U.S. No. 1; y un 4%, en U.S. No. 2., según Watkins (2004).
En la investigación de hongos presentes en la punta negra del trigo, realizada por Chávez y Kohli (2013), se identificaron 11 géneros de hongos: Curvularia, Alternaria, Helminthosporium, Fusarium, Pyricularia, Drechslera, Nigrospora, Septoria, Cladosporium, Chaetomium, y Melanospora. Los géneros Curvularia, Alternaria, Helminthosporium y Fusarium fueron predominantes en la infección de punta negra en trigo en el Paraguay.
Alternaria es un género fúngico ubicuo que incluye especies saprófitas, endofíticas y patógenas. Está asociado con una amplia variedad de sustratos, incluyendo semillas, plantas, productos agrícolas, animales, suelo y la atmósfera. Las especies de Alternaria son conocidas como graves patógenos de plantas, causando pérdidas importantes en una amplia gama de cultivos como lo mencionan Woudenberg et al. (2013). En cuanto el género Bipolaris, su relevancia en el Paraguay se suele presentar en otros cultivos de cereales como el arroz. En los años 2016 y 2017, este género presentó una incidencia media más alta asociada a la mancha foliar en las áreas de cultivo de arroz en Ñeembucú, según lo documentado por Quintana et al. (2019). Por otro lado, especies como B. sorokiniana y B. bicolor fueron observadas en semillas de trigo provenientes de diversas localidades de Brasil, tal como lo señaló Morejon et al. (2006). Estos organismos fúngicos revisten una significativa relevancia en el ámbito agrícola, particularmente debido a su estrecha asociación con el complejo patógeno implicado en la enfermedad de la Punta Negra en trigo. Por consiguiente, se hace imprescindible abordar la investigación dirigida hacia la preservación y almacenamiento óptimos de estos hongos, con el propósito de facilitar estudios subsiguientes, tales como la identificación de la variabilidad genética dentro de la población, la evaluación de su patogenicidad en cultivos huéspedes, así como la caracterización de su interacción con el hospedero. Para ello, es fundamental emplear métodos de conservación diseñados específicamente para asegurar la viabilidad y estabilidad de estas especies.
El enfoque de inmersión en agua destilada, la técnica agua destilada esterilizada tres veces (ADTE), ha demostrado su efectividad en la conservación de oomicetos, basidiomicetos, ascomicetos aeróbicos y algunos microorganismos conocidos por ser patógenos en seres humanos de acuerdo con Nakasone (2004) y Fernández et al. (2012).
En esta investigación, se tiene por objetivo evaluar la efectividad de la conservación en agua destilada-esterilizada para la preservación de los hongos fitopatógenos: Alternaria sp. y Bipolaris sp., donde se utilizó una versión adaptada de la metodología desarrollada por Ladino Rey et al. (2016), la cual involucró una serie de suspensiones en Agua-Destilada-Esterilizada 3 veces (ADTE). Este enfoque está basado en el método Castellani, que se basa en la conservación del cultivo del hongo en agua destilada estéril descrita en Panizo et al. (2005).
Materiales y métodos
Siembra de los granos de trigo
Siguiendo el protocolo de French y Herbert (1980), se desinfectaron las semillas de trigo con síntomas de la enfermedad Punta Negra, primero se sumergieron en alcohol al 70% durante 30 segundos, luego en hipoclorito de sodio 3% durante un minuto, se lavaron tres veces con agua destilada y finalmente se dejaron secar sobre papel absorbente. Todo el proceso de desinfección se llevó a cabo en una cámara de flujo laminar.
Se sembraron cinco semillas desinfectadas en posiciones equidistantes en cada placa de Petri con medio PDA (Papa, Dextrosa y Agar) de 90 mm de diámetro y se incubaron durante 5 días a una temperatura de 28±3°C. Después de que las hifas crecieran, se identificaron las colonias basándose en la morfología descrita en el manual de laboratorio “Ensayos para la semilla de maíz y de trigo” de Warham et al. (1997).
Identificación del género y obtención de los cultivos puros
De cada colonia identificada, se realizaron cinco repiques equidistantes en una misma placa con PDA. Estas placas se incubaron durante 5 días a una temperatura de 28±3°C. Una vez que los cultivos puros crecieron, se procedió a la identificación del género del hongo. Para ello, se observaron los conidios bajo el microscopio y se compararon con las fotos descritas en los ensayos de Warham et al. (1997), Manamgoda et al. (2014) y Woudenberg et al. (2013). Posteriormente, se realizaron las monosporizaciones utilizando la metodología de las diluciones seridas. Estos aislados se encuentran registrados e incluidos a la “Colección de Cultivos de Microorganismos de la Universidad Nacional de Asunción, Paraguay” (con registro de la FELACC,SI-70).
Filtrado de conidias por centrifugación y conservación de suspensiones
En medio Avena Agar (MAA), se dejaron crecer repicados de monoespóricos de los hongos por 5 a 7 días. Una vez pasado ese tiempo, se aplastaron con láminas de vidrio esterilizadas para luego incubarlos en condiciones de esporulación por 2 días en cámara húmeda (28°C±1, HR≥80% y luz constante). Pasado este tiempo, se agregó a cada cultivo 5mL de agua destilada tres veces esterilizada (ADTE) y se rasparon con láminas de vidrio esterilizadas. Seguidamente, la solución madre de cada placa se vertió en tubos de 15mL. Se centrifugaron los tubos a 2000 rpm por 5 minutos como indica Gemeda et al. (2014), para después descartar el sobrenadante y volver a centrifugar para obtener una suspensión más concentrada de 5 mL aproximadamente. La solución concentrada se diluyó en 5mL de ADTE, se filtró con una gasa estéril, y se recolectó en vasos de precipitado estériles. Los 8mL de cada suspensión se almacenaron en tubos de 2 mL para su conservación y posterior determinación de la tasa de supervivencia. Los 2 mL de suspensión sobrante de cada repetición se utilizaron para la determinación de la viabilidad.
Determinación de la viabilidad
Para la determinación de la viabilidad, se calculó la concentración de conidios/mL al momento de filtrar la solución concentrada con la gasa estéril. Para ello se utilizó la ecuación propuesta por French y Herbert (1980), utilizando un hematocitómetro, este proceso se repitió en cinco ocasiones como réplicas analíticas, y se calculó el promedio de los valores obtenidos.
Determinación de la tasa de supervivencia
Para evaluar la tasa de supervivencia tras la conservación, se calculó el valor de la tasa de super- vivencia (BSR%), por sus siglas en inglés, a través de la ecuación propuesta por Morales-García et al. (2010):
Tasa de supervivencia BSR % = Log 1+N° UFC ml DC ∗100 Log(N° UFC ml AC)
Siendo: DC: Después de la Conservación. AC: Antes de la Conservación. UFC: Unidades Forma doras de Colonias.
Para calcular el BSR%, es necesario conocer las Unidades Formadoras de Colonias por mL (UFC/mL) del T0 (tiempo 0, día 0, día en el que se llevaron las suspensiones a conservación), para compararlo con el del T1 (tiempo 1, día en el que se sacaron las suspensiones de la conservación). El conteo de microorganismos mediante técnica de extensión superficial en placa, según lo descrito por Valencia (2004) y Camacho et al. (2009), se utilizó la siguiente fórmula:
𝑈𝐹𝐶 𝑚𝑙 =𝑁° 𝑑𝑒 𝑐𝑜𝑙𝑜𝑛𝑖𝑎𝑠∗ 1 𝐹𝑎𝑐𝑡𝑜𝑟 𝑑𝑒 𝑑𝑖𝑙𝑢𝑐𝑖ó𝑛 ∗ 1 𝑚𝑙 𝑑𝑒 𝑚𝑢𝑒𝑠𝑡𝑟𝑎
Para calcular la UFC/mL, es necesario el factor de dilución:
𝐹𝑑:𝐹𝑎𝑐𝑡𝑜𝑟 𝑑𝑒 𝑑𝑖𝑙𝑢𝑐𝑖ó𝑛= 𝑔 𝑜 𝑚𝑙 𝑑𝑒 𝑚𝑢𝑒𝑠𝑡𝑟𝑎 𝑔 𝑜 𝑚𝑙 𝑑𝑒 𝑚𝑢𝑒𝑠𝑡𝑟𝑎+𝑔 𝑜 𝑚𝑙 𝑑𝑒𝑑𝑖𝑙𝑢𝑦𝑒𝑛𝑡𝑒
El UFC se evaluó a partir de 0,2 mL de la solución madre, de cada vaso. Dicha alícuota fue sembrada en placas de Petri con medio PDA en dilución 1/10. El crecimiento de las colonias se observó a intervalos de 24, 48 y 72 horas.
Determinar la estabilidad morfológica y la pureza de las colonias.
Para la evaluación de la viabilidad, estabilidad morfológica y pureza de los hongos filamentosos, se observaron las características macroscópicas y microscópicas de los cultivos.
Resultados
El método del ADTE para la conservación de hongos fitopatógenos fue eficaz para recuperar 3 de las 4 cepas evaluadas: Alt04, Bp09, Alt01 y Bp11 (Tabla 1). Se observaron sus características macroscópicas y microscópicas de dichas cepas (Figs. 1 y 2) donde se observan las particularidades de los géneros Alternaria y Bipolaris en cuanto a su coloración de colonia y forma de conidios.
Se realizaron estudios a lo largo de diferentes períodos de tiempo, expresados como T0 (Día 0), T1 (20 dpc, para Alt04; y 40 dpc para Bp09, Alt01 y Bp11) y T2 (60 dpc, para Alt01 y Bp11). Para la cepa Alt04, en el T0, a las 24 horas, se observó un valor de 161,11 UFC/mL, mientras que, a las 48 horas, el valor aumentó a 205,56 UFC/mL, en el T1, a las 24 horas, no se evidenció crecimiento visible, pero a las 48 horas, se registró un valor de 22,22 UFC/mL (Fig. 3a), lo que dio un BSR% del 63,54% (Fig. 4).
En cuanto a la cepa Alt01, dio los siguientes valores: en el T0 a las 24 horas, se observó un valor de 166,67 UFC/mL, y a las 48 horas, este valor aumentó a 475 UFC/mL. En el T1, a las 24 horas, el crecimiento fue de 35 UFC/mL, y a las 48 horas, de 130 UFC/mL. En el T2, a las 24 horas, el crecimiento fue de 5 UFC/mL, y a las 48 horas, de 10 UFC/mL (Fig. 3c), lo que resultó en un BSR% de 23,41% (Fig. 4).
La cepa Bp09 (Fig. 3b), en el T0 a las 24 horas, no se detectó crecimiento (0 UFC/mL), pero a las 48 horas, se registraron 27,78 UFC/mL. En el T1, a las 24 horas, no hubo crecimiento visible, pero a las 48 horas, se registró un valor de 50 UFC/mL, estos resultados dieron un BSR% del 47,69% (Fig. 4). Finalmente, para la cepa Bp11 (Fig. 3d), en el T0 a las 24 horas, se registró un valor de 366,67 UFC/ mL, y a las 48 horas, de 733,33 UFC/mL. En el T1, a las 24 horas, el crecimiento fue de 200 UFC/mL, y a las 48 horas, de 2530 UFC/mL. En el T2, tanto a las 24 como a las 48 horas, no se observó crecimiento visible, lo que dio un BSR% de 0 (Fig. 4).
Discusión
El método del ADTE para conservación de hongos fitopatógenos fue eficaz para recuperar 3 de las 4 las cepas evaluadas, una proporción similar a la de Ladino Rey et al. (2016), en el que las cinco de las siete cepas conservadas con agua destilada sobrevivieron hasta los cuatro meses evaluados en su estudio.
Tabla 1. Aislados estudiados en este ensayo.
| ID aislado | Género | Hospedero/Parte de planta | Año aislamiento | Fecha conservación |
| Alt01 | Alternaria | Trigo/semilla | 2023 | 31/10/2023 |
| Alt04 | Alternaria | Trigo/semilla | 2023 | 30/8/2023 |
| Bp09 | Bipolaris | Trigo/semilla | 2023 | 8/10/2023 |
| Bp11 | Bipolaris | Trigo/semilla | 2023 | 22/11/2023 |
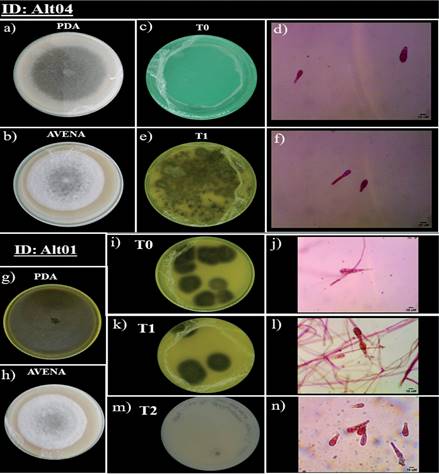
Figura 1 Observaciones macroscópicas y microscópicas de aislados de Alternaria (Alt). (a) Cultivo monoespórico en medio PDA de Alt04. (b) Cultivo monoespórico en MAA de Alt04. (c) UFC de Alt04 (T0) tras 48 horas de crecimiento (d) Conidios de colonias de Alt04, antes de la conservación. (e) UFC de Alt04 (T1) tras 48 horas de crecimiento (f) Conidios de colonias de Alt04, 40 dpc. (g) Cultivo monoespórico en medio PDA de Alt01. (h) Cultivo monoespórico en MAA de Alt01. (i) UFC de Alt01 (T0) tras 48 horas de crecimiento (j) Conidios de colonias de Alt01, antes de la conservación (k) UFC de Alt01 (T1) tras 48 horas de crecimiento (l) Conidios de colonias de Alt01, 40 dpc. (m) UFC de Alt01 (T2) tras 48 horas de crecimiento (n) Conidios de colonias de Alt01, 60 dpc
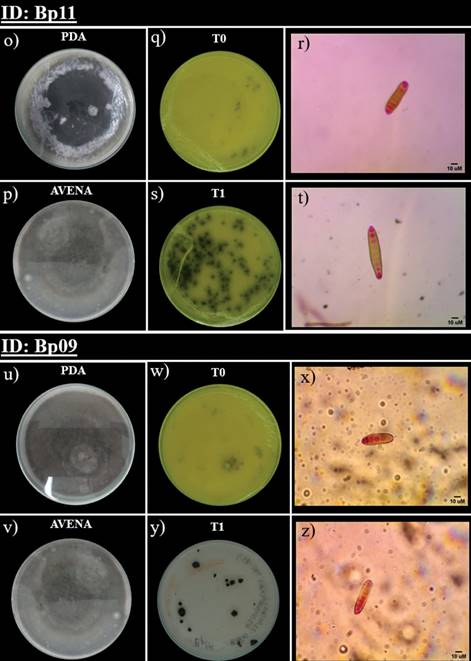
Figura 2 Observaciones macroscópicas y microscópicas de aislados de Bipolaris (Bp). (o) Cultivo monoespórico en medio PDA de Bp11 (p) Cultivo monoespórico en medio MAA de Bp11 (q) UFC de Bp11 (T0) tras 48 horas de crecimiento (r) Conidios de colonias de Bp11, antes de la conservación. (s) UFC de Bp11 (T1) tras 48 horas de crecimiento (t) Conidios de colonias de Bp11, 40 dpc (u) Cultivo monoespórico en medio PDA de Bp09 (v) Cultivo monoespórico en medio MAA de Bp09 (w) UFC de Bp09 (T0) tras 48 horas de crecimiento (x) Conidios de colonias de Bp09, antes de la conservación. (y) UFC de Bp09 (T1) tras 48 horas de crecimiento (z) Conidios de colonias de Bp09, 40 dpc
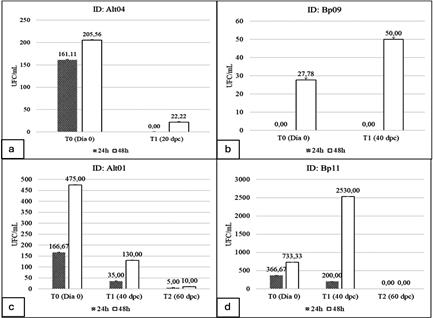
Figura 3 Comparación de las UFC/mL de la dilución 1/10 de diferentes cepas antes de la conservación (T0 = Día 0) y días post-conservación (T1 = 20 DPC/40 DPC y T2 = 60 DPC)
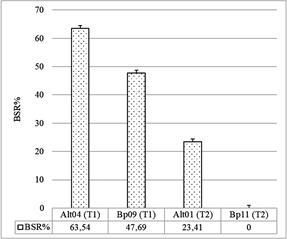
Figura 4 Tasa de supervivencia (BSR), de las cuatro (4) cepas de hongos fitopatógenos tras un crecimiento de 48 horas.
De acuerdo con los estudios de Fernández et al. (2012), en donde se reportó un porcentaje total de recuperación del 76,5%, se observó que el BSR% para la conservación de conidios en ADTE fue moderado. Específicamente, se registró un porcentaje de 43,475%, para Alternaria; y de 11,705%, para Bipolaris. En conjunto, ambos géneros dan, en conjunto, una tasa de supervivencia de 33,66%.
Como destaca Panizo et al. (2005), los métodos de conservación con agua son de bajo costo y fácil manejo, pero necesitan de constante vigilancia y atención por parte del personal que se ocupa del mantenimiento de una colección de hongos. Esto también lo mencionan Fernández et al. (2012), un método ideal para pequeñas colecciones o laboratorios con pocos recursos. Resulta útil prácticamente para todos los hongos patógenos porque ha logrado mantener la viabilidad, pureza y estabilidad por períodos de más de 20 años.
Conclusión
Se puede concluir con esta investigación que la efectividad de la conservación con ADTE para la preservación de los hongos fitopatógenos: Alternaria sp. y Bipolaris sp. de un 75% de estas especies fúngicas evaluadas durante los períodos mencionados.
Agradecimientos
Agradezco la oportunidad de participar en el Programa de Iniciación Científica a la FACEN-UNA, y al CEMIT por su apoyo financiero. Así mismo, expreso mi gratitud a los profesionales que me guiaron en el desarrollo de este programa.
Contribución de los autores
Concepción del estudio y diseño del experimento y preparación del manuscrito: A.A.M.VG y C.C.C.M. Ejecución del experimento: A.A.M.VG, P.E.F.M., V.G.G.D. Verificación del experimento: C.C.C.M., J.M.M.A. Análisis/interpretación de datos y edición/revisión del manuscrito: A.A.M.VG, C.C.C.M, J.M.M.A. Aprobación de la versión final del manuscrito: A.A.M.VG, C.C.C.M., J.M.M.A. A.A.A.W.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Fuente de financiamiento
Laboratorio de Biotecnología, Centro Multidisciplinario de Investigaciones Tecnológicas de la Universidad Nacional de Asunción y Financiación propia












 uBio
uBio 


