INTRODUCCIÓN
Se han estudiado pruebas invasivas y no invasivas para la estratificación del riesgo de eventos cardiovasculares en el contexto de la enfermedad de las arterias coronarias, la miocardiopatía y la insuficiencia cardíaca1-5. Una de las pruebas no invasivas recientes, la alternancia de ondas T de microondas y el electrocardiograma (ECG) de señales promediadas tienen valores predictivos negativos altos pero tienen un valor predictivo positivo bajo en pacientes con antecedentes de infarto agudo de miocardio (IAM), o de una miocardiopatía 3-5. Una fracción de eyección del ventrículo izquierdo baja en pacientes con cardiopatía estructural se utiliza de forma rutinaria en la práctica clínica para la estratificación del riesgo, siendo una limitación importante la falta de un valor predictivo positivo deseable para el riesgo de eventos cardiovasculares(4, 5). La presencia de complejos QRS fragmentados (fQRS) en un ECG de 12 derivaciones de rutina es otro marcador de anomalía de la despolarización6-9. Hay datos convincentes que sugieren que el fQRS representa un retraso en la conducción debido a una activación no homogénea de los ventrículos debido a una cicatriz miocárdica. Sin embargo, la fQRS no es específica de la enfermedad de las arterias coronarias y también se encuentra en otras enfermedades del miocardio, como la miocardiopatía y la cardiopatía congénita. fQRS también se ha descrito en otras entidades como la miocardiopatía arritmogénica del ventrículo derecho y el síndrome de Brugada10-13.
En 1969, Flowers et al. denominaron componentes de alta frecuencia a la presencia de complejos QRS fragmentados9. Demostraron que estas alteraciones y cambios en la morfología del complejo QRS son más comunes entre pacientes con infarto de miocardio previo y entre pacientes con agrandamiento del ventrículo derecho o izquierdo (VI). En investigaciones experimentales, Friedman et al.14 sugirieron que los cambios persistentes en las fibras de Purkinje y la fibrosis miocárdica pueden causar una activación miocárdica lenta y no homogénea en el corazón canino con IM inducido14. En el mismo modelo experimental con animales, Gardner et al sugirieron que el complejo fQRS en el corazón canino infartado es causado por una activación lenta y no homogénea asociada a la cicatrización del miocardio en lugar de cambios en el reposo transmembrana o los potenciales de acción15. La presencia de fQRS representa una distorsión de la conducción de señales y un proceso de despolarización dentro de los ventrículos que está relacionado con la cicatriz miocárdica/isquemia miocárdica o fibrosis miocárdica. Por lo tanto, se investigó el fQRS como una posible nueva herramienta para identificar a los pacientes con alto riesgo de sufrir eventos cardiovasculares.
Definición del complejo QRS fragmentado
Das et al.16 propuso una definición para el fQRS y describió los diferentes tipos (Figura 1). Lo definieron como la presencia de una onda R adicional (R') o muescas en el nadir de la onda S, o la presencia de > 1 R' en 2 derivaciones contiguas, correspondientes a un territorio de una arteria coronaria importante. El ECG de 12 derivaciones fue utilizado con rango de filtro de 0,16 a 100 Hz, filtro de CA de 60 Hz, velocidad del papel de 25 mm/s y 10 mm/mV. También definieron la fragmentación del complejo QRS ancho (wfQRS)17 en pacientes con bloqueo de rama y ritmos estimulados (Figura 2). Ellos definieron wfQRS como varios patrones RSR con o sin onda Q, con más de 2 ondas R (R') o más de 2 muescas en la onda R, o más de 2 muescas en el recorrido descendente o ascendente de la onda S, en 2 derivaciones contiguas correspondientes al territorio de una arteria coronaria importante. El fQRS, evaluado en el electrocardiograma de 12 derivaciones, representa un retraso en la conducción ventricular causada por la presencia de una cicatriz miocárdica. Posteriormente, Das et al. definieron complejos ventriculares prematuros fragmentados de manera similar a la fragmentación del bloqueo de rama y los ritmos estimulados, pero también incluyeron complejos ventriculares prematuros fragmentados con 2 muescas en la onda R que estaban separadas por más de 40 ms y presentes en 2 derivaciones contiguas18.
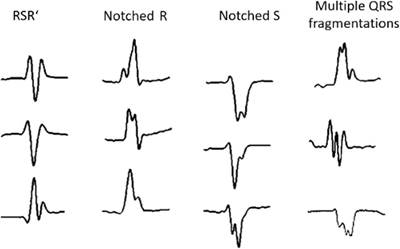
Figura 1: Esta ilustración denota diferentes morfologías del QRS fragmentado. Reimpreso con permiso de: Allescher J, Sinnecker D, von Goeldel B, et al. QRS fragmentation does not predict mortality in survivors of acute myocardial infarction. Clin Cardiol. 2024;47:e24218. doi:10.1002/clc.24218.
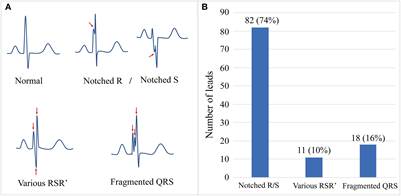
Figura 2: En esta figura se observa un diagrama esquemático y la prevalencia del complejo QRS fragmentado. (A) Los diagramas esquemáticos muestran la morfología normal del QRS y diferentes patrones de complejos QRS fragmentado. (B) El número y la proporción de tres patrones principales de QRS fragmentado. Reimpreso con permiso de: Xie J, Liu Y, Wei X, Ye W, Ma Z, Lu G, et al. Relationship Between Fragmented QRS Complex and Left Ventricular Fibrosis and Function in Patients With Danon Disease. Front. Cardiovasc. Med. 2022:9:790917. doi: 10.3389/fcvm.2022.790917.
QRS fragmentado y eventos cardiovasculares
Las enfermedades cardiovasculares constituyen la principal causa de enfermedad y muerte en los países desarrollados y también en los países en vías de desarrollo19-22. Entre las enfermedades cardiovasculares, la cardiopatia isquémica se destaca por ser la más prevalente y presentar alta morbilidad y mortalidad. 23-25) Los predictores de mal pronóstico en la cardiopatia isquémica son la función ventricular izquierda disminuida, siendo éste el más influyente; el remodelado ventricular, y el desarrollo de arritmias potencialmente malignas, entre otros26-35. A lo largo de los últimos años la búsqueda clínica de nuevos predictores de mal pronóstico en la cardiopatía isquémica ha puesto de manifiesto la presencia del QRS fragmentado en el electrocardiograma36-44. Aún sin ser específico de la cardiopatía isquémica, con una rápida obtención a muy poco costo mediante el ECG, podría asociarse a un mayor riesgo de mortalidad y eventos arrítmicos en pacientes con enfermedad coronaria (Figura 3), para agregarlo a la ya conocida fracción de eyección (FE), que demostró ser marcador pronóstico45-50.
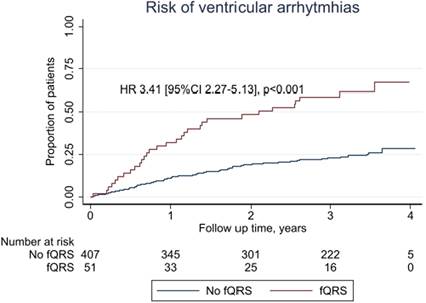
Figura 3: La figura denota el análisis de supervivencia en el tiempo hasta la aparición de la arritmia ventricular y terapia apropiada con el desfibrilador implantable ambulatorio en pacientes con y sin QRS fragmentado presente en el electrocardiograma basal. Reimpreso con permiso de: Sourour, N., Riveland, E., Rømo, T., Næsgaard, P., Kjekshus, H., Larsen, A. I., et al. QRS fragmentation is associated with increased risk of ventricular arrhythmias in high-risk patients; Data from the SMASH 1 Study. Annals of Noninvasive Electrocardiology, 2022:27, e12985. 10.1111/anec.12985
Las cicatrices del miocardio de un infarto previo pueden proporcionar el sustrato anatómico para arritmias ventriculares reentrantes letales en pacientes con cardiopatía isquémica y función ventricular izquierda disminuida. El inicio y la perpetuación de una arritmia ventricular reentrante letal dependen no sólo de un evento desencadenante como un complejo ventricular prematuro, sino también de la presencia de un sustrato miocárdico vulnerable14-16. La sensibilidad y especificidad de fQRS para la detección de cicatriz miocárdica se investigó en 479 pacientes consecutivos con y sin antecedentes de enfermedad coronaria que se sometieron a una prueba de imágenes de perfusión nuclear37. Se encontró que los complejos fQRS tienen mayor sensibilidad que las ondas Q para detectar cicatrices miocárdicas regionales, así como para la detección de cicatrices miocárdicas independientemente de la correlación regional37. Sin embargo, cuando se comparó la especificidad, la fQRS fue menos específica que la onda Q para la cicatriz miocárdica (86% frente a 99%)37. En una investigación similar, Das et al38. demostraron que la presencia de fQRS se asociaba con una mayor mortalidad por todas las causas en pacientes sin fQRS y una tasa de eventos cardíacos. En el análisis multivariado de regresión de Cox38, la fQRS fue un predictor independiente de eventos cardíacos en pacientes con enfermedad arterial coronaria (HR 1,62; p=0,0001). Pietrasik et al39. investigaron el efecto de fQRS sobre el riesgo de eventos cardíacos recurrentes en aquellos pacientes con ondas Q persistentes o resueltas a los dos meses de su primer infarto agudo de miocardio (IAM) con onda Q. El riesgo de eventos cardíacos recurrentes se definió como presentar angina inestable, IAM recurrente o muerte cardíaca en el seguimiento. En esta investigación, fQRS se asoció con un mayor riesgo de eventos recurrentes entre aquellos pacientes que habían resuelto la onda Q. Por lo tanto, se sugirió que la fQRS puede identificar miocardio isquémico39. Kadi H et al51. encontraron una asociación de fQRS dentro del contexto favorable a la cicatriz miocárdica. En dicho estudio, la fQRS parecía correlacionarse con la oclusión coronaria total crónica con circulación coronaria colateral poco desarrollada en pacientes sin IAM previo 51. Sin embargo, contrariamente a esos hallazgos, otros dos estudios no lograron mostrar una asociación significativa entre fQRS y la cicatriz miocárdica(52, 53). En primer lugar, Wang et al52. investigaron la sensibilidad y especificidad de fQRS para la detección de cicatrices de miocardio mediante imágenes de perfusión nuclear52. También evaluaron la presencia de la onda Q en 460 pacientes consecutivos con enfermedad arterial coronaria conocida o sospechada. Demostraron que la onda Q tiene mejor sensibilidad que la fQRS para detectar cicatrices de miocardio (32% frente a 2%)52. En segundo lugar, Carey et al. 53 encontraron resultados similares. Ellos estudiaron a 138 pacientes con función sistólica del VI gravemente deprimida con una fracción de eyección media del 28% a quienes se les evaluó el volumen del infarto mediante tomografía por emisión de positrones. Además, se demostró que fQRS no predecía el tamaño del infarto tanto en pacientes con complejos QRS estrechos como anchos53. Das et al. demostraron evidencia que relaciona los complejos QRS anchos fragmentados con la cicatriz miocárdica y el mal pronóstico en 879 pacientes con QRS ancho 17. Estos pacientes con complejos QRS anchos iguales o superiores a 120 ms incluyeron aquellos con bloqueo de rama, contracciones ventriculares prematuras o QRS estimulado remitidos para pruebas de esfuerzo nuclear o cateterismo cardíaco para evaluación de enfermedad arterial coronaria17. La presencia de complejo QRS ancho fragmentado se asoció con alta sensibilidad y especificidad para la cicatriz miocárdica, así como con un alto valor predictivo positivo y negativo. El complejo fQRS se asoció con un mayor riesgo de mortalidad por todas las causas después del ajuste por edad, fracción de eyección y antecedentes de diabetes mellitus17.
La presencia de fQRS y su asociación con la mortalidad en pacientes con síndrome coronario agudo se investigó en 896 pacientes40. Los pacientes del estudio se dividieron en dos grupos. Uno de los grupos tenía 337 pacientes con IAM, tanto con elevación del segmento ST (STEMI) como sin elevación del segmento ST (NSTEMI) y el otro grupo estaba compuesto por 445 pacientes con angina inestable. Hubo una diferencia estadísticamente significativa en la presencia de QRS fragmentado entre los dos grupos40. El complejo fQRS se encontró en 224 pacientes con IAM y sólo en 17 pacientes con angina inestable (51% vs 4%; p< 0,001). Además, se desarrollaron nuevas ondas Q en 122 (28%) pacientes con STEMI, en 76 (23%) pacientes con NSTEMI y solo en 2 (0,4%) pacientes con angina inestable 40. En el análisis multivariado de regresión de Cox, la presencia de fQRS se asoció con un 68% más de riesgo de mortalidad por todas las causas (HR 1,68; p=0,003) durante un período de seguimiento medio de 34±16 meses40.
Fragmentación del complejo QRS del electrocardiograma
Se definió primeramente a la fQRS como todo aquel complejo QRS con una duración menor de 120 milisegundos (ms) y al menos una muesca en la onda R o S en dos o más derivaciones pertenecientes al mismo territorio coronario16-18. Más tarde se definió la fQRS en pacientes con bloqueos de rama y en portadores de marcapasos definitivos17. Se definió como varios patrones RSR con o sin onda Q, con más de 2 ondas R (R ') o más de 2 muescas en la onda R, o más de 2 muescas en el ascenso o descenso de la onda S, en 2 derivaciones contiguas correspondientes a un territorio de una arteria coronaria16-18. El fQRS es un marcador simple de despolarización electrocardiográfica no invasiva que se usa para identificar individuos con alto riesgo de arritmias ventriculares y muerte súbita cardíaca en diversos entornos clínicos, incluida la enfermedad arterial coronaria 18.
La fragmentación del complejo QRS (fQRS) es el reflejo de un trastorno de la conducción intraventricular a causa de la presencia de cicatrices a dicho nivel, debido a múltiples causas que puedan producir en ella fibrosis16-18 (Figura 4). Para su diagnóstico se tienen en cuenta varios criterios en la morfología del complejo QRS, tanto en los que tienen éstos de duración normal o prolongada, con ritmo propio o ritmo de marcapasos. Das et al.16 definieron la fQRS y describieron varios tipos de complejos QRS fragmentados. La definieron como la presencia de una onda R adicional (R’), o muescas en el nadir de la onda S, o la presencia de 1 o más R’ en derivaciones contiguas, correspondientes a un territorio de una arteria coronaria principal en un ECG de 12 derivaciones en reposo con una velocidad del papel de 25 mm/s y 10 mm/mV16. También definieron la fragmentación del complejo QRS ancho en pacientes con bloqueo de rama y ritmos estimulados17.
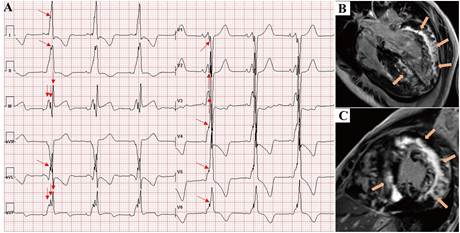
Figura 4: A) Se observan complejos QRS fragmentados en las 12 derivaciones. Se encontraron patrones R/S con muescas (flechas rojas únicas) en las derivaciones I, II, aVL y V1-V6. El patrón QRS fragmentado se observa en las derivaciones III y aVF (flechas rojas dobles), (B) Vista de cuatro cámaras y (C) vista de eje corto de imágenes de realce tardío con gadolinio por resonancia magnetica cardiaca que muestran la fibrosis/cicatrización extensa en la pared lateral del VI y fibrosis parcheada en el tabique (flechas naranjas). Reimpreso con permiso de Xie J, Liu Y, Wei X, Ye W, Ma Z, Lu G,et al. Relationship Between Fragmented QRS Complex and Left Ventricular Fibrosis and Function in Patients With Danon Disease. Front. Cardiovasc. Med. 2022:9:790917. doi: 10.3389/fcvm.2022.790917.
La fQRS en complejos anchos es descrita como la presencia de varios patrones RSR con o sin una onda Q, con más de 2 ondas R (R’) o más de 2 muescas de la onda R, o más de 2 muescas en la rama descendente o ascendente de la onda S. Así como en la definición anterior, deben de corresponder a 2 derivaciones contiguas que determinen un territorio específico de una arteria coronaria17. De igual manera, y los mismos investigadores, definieron que también esta fragmentación puede observarse en extrasístoles ventriculares, con un concepto bastante similar a la fragmentación en complejos QRS con bloqueo de rama y los ritmos estimulados. Pero con la salvedad de que, entre 2 muescas de la onda R, debería haber una distancia mayor a 40 ms, además de, también estar presente en 2 derivaciones contiguas17.
El electrocardiograma es una herramienta útil para detectar la enfermedad de las arterias coronarias y predecir los resultados en pacientes con enfermedad coronaria y en cardiomiopatías no isquémicas(54, 55). La presencia de onda Q patológica (≥40ms o ≥ 25% de la onda R) es un marcador de infarto de miocardio previo, pudiendo la misma retroceder o hasta desaparecer con el tiempo entre un 25 a 63% en pacientes con infarto de miocardio con onda Q reconocida. Su sensibilidad es baja y no existe un marcador específico para un infarto de miocardio transmural sin onda Q16. Además, se ha demostrado que la presencia del patrón RSR´, sin evidencia del bloqueo completo de rama típico (QRS ≤120ms), está asociado a aneurisma del ventrículo izquierdo por ventriculografía y cuando aparece en derivaciones inferiores se asoció trastorno de la motilidad parietal42,43.
El QRS fragmentado es un marcador de un infarto de miocardio previo, definido por anomalías regionales de perfusión, que tiene una sensibilidad sustancialmente mayor y un valor predictivo negativo en comparación con la onda Q43. El QRS fragmentado evaluado en el electrocardiograma de 12 derivaciones representa un retraso en la conducción ventricular causado por la presencia de un miocardio cicatricial. Aún sin ser específico para enfermedad coronaria, se asoció a la fQRS con un riesgo aumentado de mortalidad y riesgo de eventos arrítmicos. Además, su asociación conocida con la baja fracción de eyección del ventrículo izquierdo, probó ser un buen marcador pronóstico42.
Fragmentación del complejo QRS y la enfermedad isquémica coronaria
El avance de la medicina ha ayudado en gran medida al aumento de la sobrevida en la población general, pese al crecimiento exponencial de las enfermedades cardiovasculares a nivel mundial. Las enfermedades cardiovasculares (ECV) actualmente son la principal causa de muerte en los países industrializados y en vías de desarrollo. Entre ellas, la cardiopatía isquémica es la manifestación más prevalente, y se asocia a alta morbimortalidad1-5. Las ECV a menudo debutan con un episodio agudo debido a una complicación aterotrombótica: síndromes coronarios agudos (incluyendo la muerte súbita en un 15-20% de los casos) e ictus, como principales manifestaciones2.
Aunque la tasa de mortalidad por cardiopatía isquémica ha descendido en las últimas cuatro décadas en los países desarrollados, sigue siendo la causa de aproximadamente un tercio de todas las muertes de sujetos de edad >35 años(1, 4). La tasa de incidencia, entendida como el número de casos nuevos de una enfermedad en una población y un periodo determinados, se suele estimar a partir de estudios de cohortes, registros específicos o estadísticas oficiales, como los datos de registros de altas4. Datos de 44 años de seguimiento de la cohorte original del Estudio Framingham y 20 años de la descendencia de la cohorte original han arrojado diversas observaciones demográficas, sobre todo la influencia del sexo y la edad en la incidencia de EC, que conceptualmente son extrapolables a la mayoría de las poblaciones y al momento actual(26, 27) Dentro de la mejoría de la sobrevida, uno de los principales factores, es la búsqueda constante de estrategias de prevención secundaria y terciaria, desde cambios de estilo de vida, alimentación, uso de medicamentos y dispositivos, todo esto basado en el estudio minucioso del cuadro clínico e individualismo del paciente.
Aunque se ha logrado un progreso sustancial en el diagnóstico y tratamiento de los síndromes coronarios agudos (SCA), la enfermedad cardiovascular sigue siendo la principal causa de muerte en todo el mundo, y casi la mitad de estas muertes se deben a cardiopatía isquémica(1, 4). El diagnóstico y la evaluación de la enfermedad coronaria involucra al examen clínico, métodos de estudio no invasivos (estudios multimodales) e invasivos como la angiografía coronaria1. En el contexto de la cardiopatía isquémica se siguen buscando factores de riego y pronósticos que puedan ayudar a evitar la muerte súbita en este numeroso y heterogéneo grupo de pacientes. Uno de estos factores es la fQRS, que consiste en la presencia adicional de ondas R (R’) u ondas S (S’), uno dentro de un complejo de duración inferior a 120 ms, y dos o más en un complejo de duración mayor a 120 ms, afectando al menos 2 derivaciones correspondientes a una cara (inferior, septal, anterior y lateral). La adición de elementos diagnósticos previo a la coronariografía, como el electrocardiograma es de vital importancia ya que determina conductas en el manejo de los pacientes. Además, hallazgos en el electrocardiograma como la fragmentación del QRS puede ser de utilidad para estimar la presencia y severidad de la enfermedad coronaria, ya que el mismo constituye reflejo de trastornos en la conducción ventricular que están fuertemente relacionados con fibrosis miocárdica e isquemia17.
La fragmentación de QRS no es un parámetro exclusivo de la enfermedad isquémica coronaria, sino que se extiende más allá de la cardiopatía isquémica con sus repercusiones arrítmicas y trastornos del sistema de conducción(6, 7) ya que se la relaciona inclusive con pronóstico en el deterioro clínico y la mortalidad en la tromboembolia pulmonar8. Por ello, es de capital importancia su reconocimiento y descripción en el momento de la lectura en interpretación del electrocardiograma.
En el trabajo de Torales JM. et al.6 hemos demostrado que la presencia de fragmentación del complejo QRS en el electrocardiograma posee una alta especificidad y un alto valor predictivo positivo de la existencia de trastornos segmentarios de la motilidad miocárdica en pacientes con cardiopatía isquémica. Esto tiene una gran implicancia clínica ya que con un simple electrocardiograma que es un método auxiliar de diagnóstico eficaz, rápido, barato y altamente disponible, podemos asumir que un paciente tiene además alteraciones de la motilidad parietal segmentaria del miocardio ventricular6.
Estos autores6 encontraron que la mayoría de los pacientes era del sexo masculino, esto concuerda con el trabajo realizado por Yildirim E. et al48. y Akbarzadeh F et al.36 En cuanto a la edad, el promedio fue de 63 años aproximadamente, otro dato también comparable a los de estos estudios mencionados. Además, han encontrado que el factor de riesgo más prevalente fue la hipertensión arterial, seguido del hábito tabáquico, y posteriormente de la DM2 y la dislipidemia6, lo primero concuerda con el trabajo realizado por Morillas Climent H, et al. 56 no así el segundo factor de riesgo que en dicho estudio fue la dislipidemia en conjunto con el tabaquismo32.
Torales JM. et al6 encontraron con respecto a la fracción de eyección que el 52% tenía fracción de eyección menor a 50% (siendo la media de 48±13), estos datos concuerdan con los trabajos anteriormente mencionados en los que la mayoría de los pacientes tenían FE menor al 50%33-35. En nuestro trabajo 6 pudimos constatar que el 44% de los pacientes presentó fQRS, similar al trabajo realizado por García M et al.57 (47,4 %) y al estudio de Morillas Climent H et al. 56 (41,79 %) y una incidencia un poco menor con el trabajo de Yan et al.58 donde se detectó fQRS en el 31% de los pacientes.
Teniendo en cuenta la localización de la fQRS en el ECG y la localización de la alteración de la motilidad en la ecocardiografía, la cara inferior fue la más frecuente por ECG y la apical e inferior por ecocardiografía, esto concuerda en parte con el trabajo realizado por García M et al35, en el que la localización más frecuente fue la cara inferior.
Torales JM et al.6) observaron que de los 36 pacientes con fQRS, 30 presentaban trastornos segmentarios de la motilidad miocárdica, mientras que 6 pacientes no la presentaban. Por otro lado, de los 45 pacientes sin fQRS, 28 tenían trastornos segmentarios de la motilidad, mientras que 17 no tenían, lo que nos da una sensibilidad del 52% (SnNout moderado) y una especificidad del 74% (SpPin alto), con una VPP del 83%, un VPN del 38 % y una prevalencia del 72%. Estos datos son similares a los del estudio de García M et al en el cual en el 72% de los pacientes con fQRS se observó algún trastorno de motilidad parietal en el ecocardiograma 6 y en el estudio publicado por Michael MA et al.59, y Das MK, et al. 60 donde concluyeron que el fQRS es altamente específico y moderadamente sensible como signo de síndrome coronario agudo reciente.
Con todos estos datos podemos asumir que en cada tres de cuatro ECGs que analicemos, al observar un QRS fragmentado en el mismo, podríamos suponer que es muy probable que también encontremos una alteración de la motilidad miocárdica en la ecocardiografía. Varios estudios reportaron mayor sensibilidad de la fQRS que la onda Q para la detección de cicatriz miocárdica y postularon que la presencia de fQRS podría ser un buen predictor de eventos cardíacos entre los pacientes con enfermedad arterial coronaria35. Además la fácil obtención del hallazgo de la fQRS en el electrocardiograma de 12 derivaciones, lo hace una herramienta fácil, económica, y rápidamente disponible en cualquier momento.
La fragmentación del complejo QRS y otras entidades cardiovasculares
La fragmentación del complejo QRS no solo se limita a su relación con la enfermedad coronaria. En el 2017, Meng L, et al.11 realizaron un meta-análisis que investigó la importancia del QRS fragmentado para pronosticar el deterioro clínico y la mortalidad de la embolia pulmonar a raíz de que la presentación clínica tiene una alta tasa de mortalidad. Se concluyó en dicho estudio que la presencia de QRS fragmentado predijo significativamente la mortalidad hospitalaria (OR 2.92; CI: 95%; p <0.01); el Shock cardiogénico (OR: 4.71, IC: 95%, p =0.005) y la mortalidad total a los 2 años de seguimiento (OR: 4.4; IC 95%; p <.001)11. La fQRS demostró ser un predictor de eventos cardiovasculares como arritmias ventriculares, la muerte súbita y el aumento de la mortalidad por cualquier causa en pacientes con cardiopatía isquémica43, síndrome de Brugada61, miocardiopatía hipertrófica62 y otras entidades63-65.
Recientemente, la pandemia por coronavirus 19 (COVID-19) ha demostrado afectación cardiovascular por el coronavirus y entre ellas aumento de la incidencia de infarto de miocardio con riesgo aumentado en pacientes con factores de riesgo y trastornos de la conducción auriculo ventricular, como también, trastornos de la repolarización segmentaria del VI63,64. Parece ser que la gravedad de la infección por COVID-19 se relaciona con características electrocardiográficas entre las cuales se encuentran la depresión de segmento ST, inversión de la onda T y presencia de QRS fragmentado63,64.
La fQRS es un marcador de despolarización del ECG no invasivo simple que se utiliza para identificar personas con alto riesgo de arritmias ventriculares y muerte súbita cardiaca en diversos entornos clínicos, incluida la enfermedad de las arterias coronarias, el síndrome de QT largo, la miocardiopatía arritmogénica del ventrículo derecho, Síndrome de Brugada y la sarcoidosis cardíaca61-66. El síndrome de Brugada es una canalopatía genéticamente heterogéneo caracterizado por la aparición en el electrocardiograma de elevación del segmento ST en derivaciones precordiales derechas en ausencia de daño estructural evidente61. Se asocia con un alto riesgo de fibrilación ventricular, síncope y muerte súbita cardíaca que ocurre en la tercera y cuarta década de vida comparado con la población general. Sin embargo, la mayoría de los pacientes con síndrome de Brugada son asintomáticos y el diagnóstico es hecho como hallazgo incidental61.
CONCLUSIÓN
En conclusión, la importancia y el valor predictivo del complejo fQRS como marcador ECG de eventos cardiovasculares parecen ser diferentes en diferentes entidades. En pacientes con enfermedad arterial coronaria estable y en pacientes con infarto de miocardio agudo, la fQRS parece ser un buen predictor de eventos cardíacos. En pacientes con miocardiopatía no isquémica, la fragmentación del complejo QRS estrecho parece correlacionarse con el grado de fibrosis y disincronía y, de manera importante, puede influir en la respuesta a la terapia de resincronización cardíaca. En pacientes con disfunción del VI, no hay evidencia clara de que la presencia de fQRS pueda predecir eventos arrítmicos. Por otro lado, hubo diferencia estadísticamente significativa en la mortalidad asociada a la presencia de QRS fragmentado en pacientes con síndrome coronario agudo y necrosis miocárdica. La presencia de fragmentación del complejo QRS en el electrocardiograma, posee una alta especificidad y un alto valor predictivo positivo de la existencia de trastornos segmentarios de la motilidad miocárdica en pacientes con cardiopatía isquémica.















