Introducción
Paraguay ocupa el quinto lugar como mayor productor de soja del mundo detrás de Brasil, Estados Unidos, Argentina, China e India (SoyStats, 2021), mientras que se encuentra posicionado como cuarto mayor exportador de este grano a nivel mundial. En la campaña 2020/2021 Paraguay produjo un total de 9.518.600 t en 3.400.000 ha de siembra, con un rendimiento promedio de 2.800 kg ha-1 (Cámara Paraguaya de Exportadores y Comercializadores de Cereales y Oleaginosas (CAPECO), 2022). Las exportaciones de soja en Paraguay empezaron desde el año 1989 con un total de 945.375 t, y actualmente se exportan 6.510.141 t de granos (Duarte et al., 2017; CAPECO, 2022). De esta forma, con el aumento de la producción de soja en Paraguay, se han fortalecido ciertas industrias como las aceiteras y la de los defensivos agrícolas, así también ha promovido la generación de empleo directo e indirecto en toda la cadena productiva, ya que el cultivo de soja representa aproximadamente el 65% del PIB agrícola o 12% del PIB total; convirtiéndolo así en el principal rubro de producción agrícola y de exportación del país (Mesa de la Roya, 2018).
En Paraguay, la soja se siembra a partir del mes de setiembre y dependiendo de las condiciones ambientales y del genotipo utilizado, esta siembra puede retrasarse hasta octubre y noviembre (Enciso-Maldonado et al., 2021a). El retraso de la siembra repercute, algunas veces, en una disminución de la productividad y en un aumento de la presión de inóculo del patógeno (Enciso-Maldonado et al., 2019; Enciso-Maldonado et al., 2021a).
La roya asiática de la soja (RAS) es una enfermedad causada por Phakopsora pachyrhizi, un hongo biotrófico y policíclico que se encuentra disperso en las zonas productoras de soja del mundo (Langenbach, Campe et al., 2016), pudiendo ocasionar perdidas de rendimiento del 80 % (Hartman et al., 2015). Para que ocurra la infección de RAS es necesario un periodo de al menos seis horas de mojado foliar y temperaturas entre 15 a 30 °C, mientras que infección optima ocurre entre los 21 a 24 °C (Nunkumar et al., 2013).
El manejo integrado de la RAS incluye prácticas que permiten reducir la fuente de inoculo en el ambiente, como por ejemplo la utilización de variedades resistentes y precoces (Yorinori et al., 2005), el monitoreo y eliminación de hospederos alternativos, y el cumplimiento del vacío sanitario (Xavier et al., 2015) y, en última instancia, la aplicación de fungicidas (Langenbach et al., 2016).
El uso de variedades resistentes es una práctica con baja adopción por parte de los agricultores paraguayos, ya que solamente 1,47 % de la superficie de siembra de soja es ocupada con este tipo de tecnología (Ishikawa-Ishiwata & Furuya, 2021), y, por otro lado, la siembra de la soja zafriña permite que el inóculo se mantenga en el campo y tenga mayor probabilidad de sobrevivir hasta una siguiente temporada de siembra (Maidana-Ojeda, 2021).
En contraste, el control químico con fungicidas es la practica más eficaz para el controlar de la RAS (Langenbach et al., 2016). Los principales grupos de fungicidas utilizados para el control de la RAS en soja en Paraguay son los inhibidores de la síntesis de esteroles (DMI, por sus siglas en inglés), los inhibidores de la quinona externa (QoI, por sus siglas en inglés) y los inhibidores de la enzima succinato deshidrogenasa (SDHI, por sus siglas en inglés), los cuales son comercializados en pre-mezclas que contienen dos a tres ingredientes activos (DMI + QoI, DMI + SDHI, QoI + SDHI o DMI + QoI + SDHI) y aplicados de manera alternada en tres a cinco aplicaciones por ciclo de cultivo (Enciso-Maldonado et al., 2021b).
Una de las limitantes del control químico es que los fungicidas para el control de la RAS en Paraguay tienden a reducir su eficacia de control a una tasa de 8,49% anual (Ishikawa-Ishiwata & Furuya, 2021). Esto se debe a que estos fungicidas actúan en un sitio específico de reacciones bioquímicas en la célula fúngica, por lo tanto, son vulnerables a la selección de cepas insensibles (Godoy et al., 2016). Las causas de esta reducción de la eficacia de control en el campo son varias: eflujo, sobreexpresión, desintoxicación y mutaciones en el sitio objetivo, sin embargo, las mutaciones puntuales en los genes objetivo son el principal mecanismo de hongos fitopatógenos para adquirir resistencia a los fungicidas (Brent & Hollomon, 1995). Por ejemplo, los fungicidas DMI actúan sobre la 14-α desmetilasa en la ruta de biosíntesis de ergosterol, codificada por el gen CYP51; los QoI actúan sobre una proteína de la enzima citocromo bc1-ubiquinol oxidasa, codificada por el gen mitocondrial CYTB; y los fungicidas SDHI actúan sobre el complejo succinato deshidrogenasa en la cadena respiratoria, codificado por el gen Sdh (Müller et al., 2021; Gisi et al., 2000; Gisi et al., 2002; Grasso et al., 2006; Yankovskaya et al., 2003). El Comité de Acción de Resistencia a Fungicidas (Fungicide Resistance Action Committee (FRAC), 2020a, 2020b, 2020c) clasifica a los DMI como fungicidas de riesgo medio, y a los QoI y SDHI como fungicidas de alto riesgo para el desarrollo de resistencia por parte de los patógenos, por esta razón, se recomienda utilizarlos en soja siempre en mezclas junto a otro fungicida con un modo de acción diferente, aplicarlos preventivamente y no confiar únicamente en sus propiedades curativas de ambos grupos de forma aislada o en mezcla. Además, recomiendan aplicar un máximo de dos pulverizaciones que contengan fungicida SDHI por cultivo de soja (contando la entrezafra), limitar el número de pulverizaciones que contienen fungicidas QoI y aplicar los DMI siempre en los intervalos recomendados por los fabricantes, evitando los intervalos de pulverización prolongados.
Una estrategia para retrasar la generación de resistencia a fungicidas es la rotación de diferentes fungicidas o mezclas de estos, es decir, aplicar los fungicidas alternadamente o en asociación con otras moléculas con diferente modo de acción (Brent & Hollomon, 1995). Por lo tanto, el objetivo de este trabajo fue evaluar el efecto de programas de aplicación de fungicidas con diferentes modos de acción sobre la severidad de la RAS y la productividad de la soja.
Materiales y Métodos
Se llevaron a cabo dos ensayos por localidad en dos temporadas distintas. El primer ensayo se realizó en la Colonia Naranjito, Itapúa (26° 21' 36,41'' S y 51° 14' 39,65'' O) durante la temporada 2016/2017, donde la primera siembra (S1) fue el 6 de setiembre y la segunda siembra (S2) fue el 6 de octubre de 2016. Mientras que el segundo ensayo se realizó en Yguazú, Alto Paraná (25° 27' 43,75'' S y 55° 2' 3,98'' O) durante la temporada 2017/2018, donde la S1 fue el 20 de setiembre de 2017 y la S2 el 20 de noviembre de 2017.
Durante el periodo experimental en Naranjito la temperatura media de 22,3 °C, humedad relativa de 75,6 % y precipitación total de 788 mm (Figura 1A) y en Yguazú la temperatura media fue de 24,9 °C, la humedad relativa de 68,7% y la precipitación alcanzó 830 mm (Figura 1B).
Se evaluaron once programas de aplicación de fungicidas (PAF) en donde se rotaron los ingredientes activos; se incluyó un testigo sin aplicación de fungicidas (Tabla 1). Para los ensayos se utilizó la variedad NA 5909 RR, la cual fue inoculada con 200 mL 100 kg-1 de semilla con Rizoliq® TOP, el cual contiene 1 x 1010 unidades formadoras de colonias por mL de Bradyrhizobium japonicum. La siembra se realizó con un tractor/sembradora (modelo SHP 249, Semeato Plantio Direto, Passo Fundo, RS, Brasil), utilizando un sistema de labranza cero donde se aplicó 150 kg ha-1 de 04-30-10 como fertilizante de base. A excepción de la aplicación de fungicidas, otros manejos y tratamientos culturales siguieron las recomendaciones agronómicas estándar para el cultivo de soja (Díaz-Zorita & Duarte, 2004). Los PAF se realizaron con una pulverizadora a costal presurizada con CO2, con volumen de pulverización de 150 L ha-1, con picos tipo cónico M053 y espaciados entre sí a 50 cm, a una presión de a 30 bar y a una velocidad de 5 km h-1 a partir de la ocurrencia del estadio fenológico R1, con intervalos de aplicación de 15 a 18 días entre pulverizaciones. En Naranjito las aplicaciones se realizaron en S1 a los 52, 70, 88 y 106 días después de la siembra (dds) y en S2 a 46, 63, 81 y 99 dds; en Yguazú a 48, 66, 84 y 102 dds y a 46, 64, 80 y 97 dds en S1 y S2, respectivamente. En cada ensayo los tratamientos se distribuyeron en un diseño en bloques completos al azar con tres repeticiones, con 48 unidades experimentales de 11,3 m2, con cinco hileras de 0,45 m de separación y una densidad de siembra de 300.000 plantas ha-1. En cada unidad experimental se determinó un área útil de 5,4 m2, donde se tomaron los datos de las variables de las tres hileras centrales, eliminando 0,5 m de cada extremo.
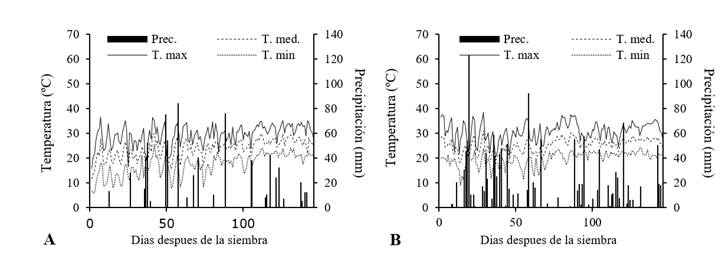
Figura 1. Condiciones meteorológicas registradas durante el periodo experimental en (A) Naranjito ciclo 2016/2017; e (B) Yguazú ciclo 2017/2018.
Tabla 1. Diferentes programas de aplicación de fungicidas y orden de aplicaciones.
| Tratamiento | 1° aplicación | 2° aplicación | 3° aplicación | 4° aplicación |
| T1 (Testigo) | Agua | Agua | Agua | Agua |
| T2 | (Az + B)1 + Dz2 | Az + B | Az + Cp6 | |
| T3 | Pr + Tr3 | Pr + Tr | Fl + Ep + Pi | |
| T4 | Pr + Tr | Pr + Tr | Tr + Cp7 | Tr + Cp |
| T5 | Pr + Tr | Az + B | Fl + Ep + Pi | |
| T6 | Pc + Cp4 | Pr + Tr | Az + B | Fl + Ep + i |
| T7 | (Az + B) + Dz | Pr + Tr | Fl + Ep + Pi | Pc + Cp |
| T8 | Fl + Ep + Pi5 | Pr + Tr | Az + B | |
| T9 | Pr + Tr | (Az + B) + Dz | Fl + Ep + Pi | |
| T10 | Pc + Cp | Pr + Tr | Az + B | Pc + Cp |
| T11 | Pc + Cp | Pr + Tr | Az + B | |
| T12 | Fl + Ep + Pi | Pr + Tr | Fl + Ep + Pi |
1Azoxistrobina (30 %) + Benzovindiflupyr (15 %), dosis 0,2 kg ha-1; 2Difenoconazol (25 %) dosis 0,3 L ha-1; 3Prothioconazol (17,5 %) + Trifloxistrobina 15 %, dosis 0,4 L ha-1; 4Picoxistrobina (20 %) + Ciproconazol (8 %), dosis 0,3 L ha-1; 5Fluxapyroxad (5 %) + Epoxiconazol (5 %) + Piraclostrobina (8,1 %), dosis 0,8 L ha-1; 6Azoxistrobina (60 %) + Ciproconazol (24 %), dosis 0,3 L ha-1; 7Trifloxistrobina 37,5% + Ciproconazol 16 %, dosis 0,2 L ha-1.
La severidad se evaluó a los siete días después de la cuarta aplicación de fungicidas. Se recolectaron diez hojas al azar del estrato medio, siguiendo una trayectoria en forma de zigzag para tomas las muestras. Posteriormente, se cuantificó la severidad comparando las zonas ocupadas por RAS con la escala diagramática propuesta por Godoy et al. (2006). La misma presenta seis niveles de severidad: 1 = 0,6 %, 2 = 2 %; 3 = 7 %; 4 = 18 %; 5 = 42 %; 6 = 78,5 %. A partir de los promedios de severidad se calcularon los porcentajes de eficacia de control (EC) para cada tratamiento por época de siembra y localidad con la siguiente fórmula:
El rendimiento se determinó cosechando todas las plantas del área útil de manera manual cuando el cultivo alcanzó el estadio fenológico de madurez de cosecha (R8) (Fehr et al., 1971). La humedad del grano fue corregida al 13 %.
Los datos se sometieron a un análisis de varianza de modelo mixto (ANOVA) utilizando los paquetes lme4 y lmerTest en el software R (Carstensen et al., 2021). Los PAF, la época de siembra y la interacción de ambos factores se consideraron efectos fijos, mientras que la repetición y el término de error general se consideraron efectos aleatorios. Se usó el paquete multcompView para probar la diferencia significativa de las medias de efectos fijos, donde se utilizó la prueba de Tukey con una probabilidad de error del 5% (α = 0,05).
Resultados
Los efectos de los factores experimentales sobre las variables de respuesta evaluadas se resumen en la Tabla 2. El análisis de varianza indicó diferencias significativas para la interacción época de siembra×PAF únicamente sobre la severidad de la RAS en Naranjito (P<0,001). La severidad de RAS en Yguazú y el rendimiento en Naranjito fueron influenciados por la época de siembra (P<0,001) y por los PAF de manera independiente (P<0,001). Mientras que el rendimiento en Yguazú solamente fue afectado por la época de siembra (P<0,01). Además, el porcentaje de severidad de RAS fue mayor en S2 en ambas localidades.
En Naranjito se observaron valores máximos de severidad en los testigos, entre 34 y 45 % en S1 y S2, respectivamente, mientras que los PAF mostraron valores de severidad entre 4 y 22 % en S1 y 8 y 17 % en S2 (Figura 2A). La menor EC se observó con T2, alcanzando valores de entre 37 y 62 % para S1 y S2, respectivamente, mientras que para los tratamientos T3 a T12, la EC varió de 76 a 89 % en S1 y entre 73 a 81 % en S2. En cuanto al rendimiento los testigos alcanzaron rendimientos promedios de 2864 y 3532 kg ha-1 en S1 y S2, Con los PAF los rendimientos oscilaron entre 3493 y 4105 kg ha-1 en S1, y entre 4024 y 4778 kg ha-1 en S2 (Figura 2B).
En Yguazú la severidad máxima también fue observada en los testigos, con valores de entre 28 y 59 % en S1 y S2, mientras que con los PAF la severidad fue de entre 1,0 y 17 % en S1 y entre 21 y 28 en S2 (Figura 3A). La menor EC con T12 en S1 con 39 %, mientras que con los PAF la EC varió entre 85 y 97 % en S1 y entre 53 a 65 % en S2. El rendimiento de los testigos fue de 3082 y 2906 kg ha-1 en S1 y S2, respectivamente. Mientras que con los PAF los rendimientos oscilaron entre 3353 y 4084 kg ha-1 en S1 y entre 2925 y 3974 kg ha-1 en S2 (Figura 3B).
Tabla 2. Influencia de la severidad de la roya asiática de la soja y el rendimiento en función de los tratamientos estudiados en las localidades y fechas de siembra.
| Parámetros | Naranjito | Yguazú | ||
|---|---|---|---|---|
| Severidad | Rendimiento | Severidad | Rendimiento | |
| Siembra (S) | ** | ** | ** | * |
| Tratamiento (T) | ** | ** | ** | ns |
| S×T | ** | ns | ns | ns |
* Significancia en P=0,05; ** Significancia en P=0,001; ns: no significativo.
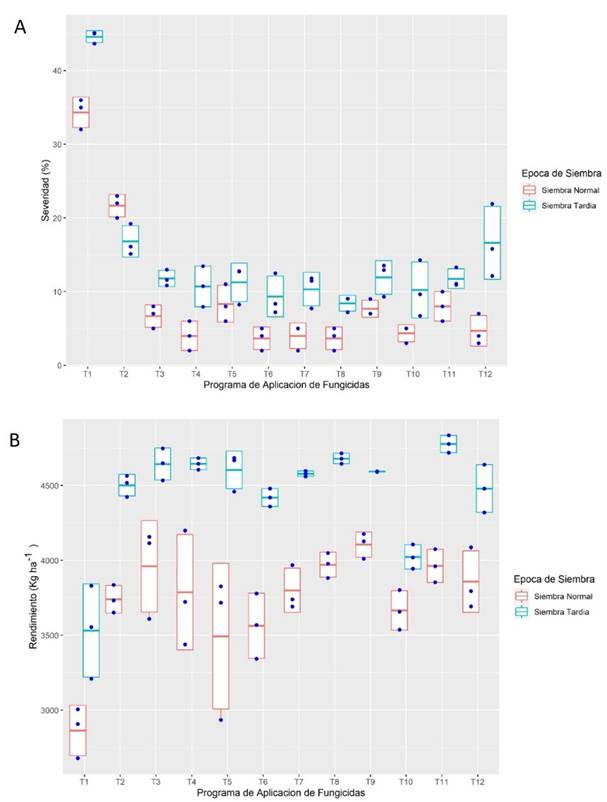
Figura 2. Severidad de roya asiática y rendimiento de granos de soja bajo diferentes programas de aplicación de fungicidas en a los 112 (siembra normal) y 106 dds (siembra tardía) en Naranjito, Itapúa, Paraguay. A) Severidad y B) Rendimiento. Los diagramas de cajas con rayas representan la media de tres repeticiones y los extremos la desviación estándar. Las barras representan los valores extremos y puntos las observaciones individuales.
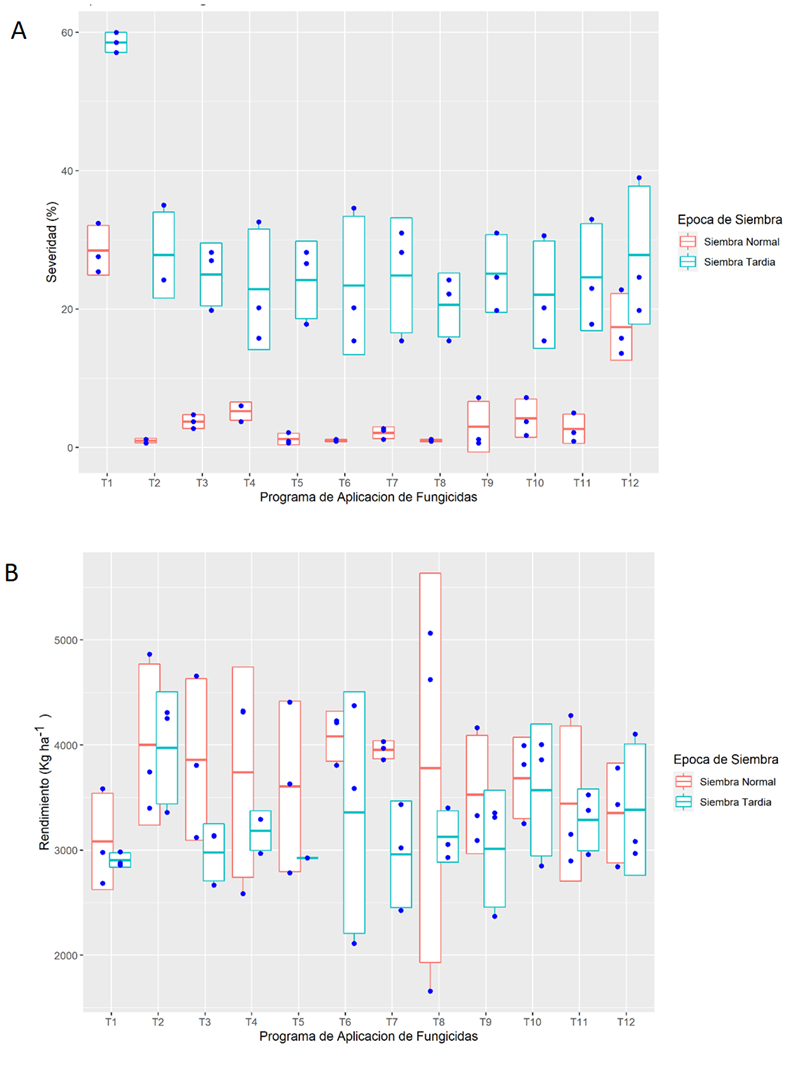
Figura 3. Severidad de roya asiática y rendimiento de granos de soja bajo diferentes programas de aplicación de fungicidas en a los 109 (siembra normal) y 104 dds (siembra tardía) en Yguazú, Alto Paraná, Paraguay. A) Severidad y B) Rendimiento. Los diagramas de cajas con rayas representan la media de tres repeticiones y los extremos la desviación estándar. Las barras representan los valores extremos y puntos las observaciones individuales.
Discusión
Todos los PAF evaluados en este estudio, proporcionaron cierto nivel de control de la RAS en el cultivo de soja a nivel de campo en localidades y temporadas distintas. En trabajos anteriores realizados en Yguazú (Alto Paraná, Paraguay) y María Auxiliadora y Natalio (Itapúa, Paraguay), se ha observado que diferentes PAF reducen la severidad de la RAS por debajo del 10 % y ejercen un control de la RAS por encima del 85 % (Schlickmann-Tank & Enciso-Maldonado, 2019; Maidana-Ojeda et al., 2021; Zacaría-Villalba et al., 2021). Sin embargo, estos trabajos no contemplan su repetición en diferentes localidades ni presión de inoculo. En los sitios de evaluación de esta investigación, las condiciones ambientales fueron favorables para el desarrollo de la RAS (Figura 1). Además, la respuesta del control químico fue la esperada, donde, a medida que se retrasa la siembra, la presión de inoculo es mayor y la EC de fungicidas tiende a disminuir (Godoy et al., 2016a; Enciso-Maldonado et al., 2021b; Maidana-Ojeda et al., 2019). En esta investigación, la presión de inóculo se refleja en el nivel de severidad en los testigos de cada experimento, siendo mayor en la segunda época para cada localidad. Ploper et al. (2015), señalan que la variación de la presión de inóculo y de las condiciones ambientales provocan diferencias en la respuesta de la severidad de la RAS al control químico en varios sitios en un mismo año y en años diferentes, lo cual fue observado en este trabajo.
Para prevenir la perdida de EC de los fungicidas y prolongar los PAF por varios años, es fundamental que se hagan disponibles estudios de monitoreo de sensibilidad de poblaciones P. pachyrhizi de diferentes localidades de la zona de producción contra los distintos modos de acción de fungicidas de manera aislada y en mezclas. En Paraguay, los reportes de eficacia de control son escasos (Arrua et al., 2021; Enciso-Maldonado et al., 2021b), sin embargo, se ha observado un bajo control de Azoxistrobina + Ciproconazol (Enciso-Maldonado et al., 2016), pudiendo indicar una alta probabilidad de que existan cepas resistentes a uno de los ingredientes activos de esta premezcla, y también podría explicar la reducida EC observada con T2. Por esta razón es importante realizar pruebas de EC de fungicidas a nivel regional, ya que, si la EC de determinada premezcla es baja, repercutirá en un PAF ineficiente, provocando un aumento de la severidad, mayor probabilidad de que el patógeno un nuevo ciclo de la enfermedad dentro del cultivo y, consecuentemente, mayor defoliación y perdidas de rendimiento.
El Prothioconazol es un fungicida que presenta una actividad fungitóxica superior y un mecanismo de inhibición diferente en comparación con otros DMI y hasta el 2016 no se ha reportado disminución en su EC ni pérdida de sensibilidad por parte del patógeno (Moura et al., 2016; Parker et al., 2011; Xavier et al. 2015), sin embargo, en trabajos recientes P. pachyrhizi se ha observado que la sensibilidad de P. pachyrhizi al Prothioconazole ha sido reducida hasta 10 veces en algunas regiones de Paraguay (Braga et al., 2020). Por otro lado, el Prothioconazole en mezcla con Trifloxistrobina ha mostrado un alto porcentaje de control por varios años (Godoy et al., 2016a), por lo tanto, es incluido en la mayoría de los PAF de las empresas comerciales en Paraguay. La inclusión de esta mezcla en los tratamientos evaluados en este trabajo ha ofrecido buen control de la enfermedad (>70 %) en la mayoría de los ensayos.
Además de la EC de los fungicidas, el volumen de aplicación es otro factor que influye en la eficacia de algunas premezclas de fungicidas como Trifloxistrobina + Prothioconazol y Azoxistrobina + Benzovindiflupir, las cuales alcanzan mayores EC cuando mayor es el volumen de aplicación (Chechi et al., 2019). Este factor debería ser estudiado a la hora de seleccionar determinado fungicida dentro de un PAF, para maximizar su EC.
Por otra parte, la realización de una cuarta aplicación de fungicidas no se reflejó en menores niveles de severidad ni en mayores rendimientos, una situación similar también fue reportada por Ploper et al. (2015), quienes observaron que no hubo efecto sobre el rendimiento ni la RAS ni sobre las enfermedades de final de ciclo cuando se realizaron una o dos aplicaciones de fungicidas. El número de aplicaciones por ciclo de cultivo es un factor al que se debe prestar importancia, debido a que influirá en el costo de producción. En los trabajos de Maidana-Ojeda et al. (2021) no hubo diferencia en el rendimiento ni en la severidad cuando se aplicaron diferentes PAF con tres y cuatro aplicaciones. Por otro lado, Enciso-Maldonado et al. (2021c), mencionan que el costo de controlar enfermedades de soja puede ser mayor que el daño ocasionado por las mismas, por lo tanto, es recomendable que el número de aplicaciones por ciclo de cultivo se realice en función a las condiciones ambientales o a la presencia del inóculo en el ambiente (Carmona et al., 2010; Maidana-Ojeda et al., 2019, Ploper et al., 2015). Estas prácticas permitirán realizar un manejo sostenible de fungicidas y reducir los riesgos de generación de resistencia por parte del patógeno, debido a que la aplicación de fungicidas en momentos oportunos permitirá mantener la EC de estos al máximo y la tasa de infección del patógeno al mínimo, reduciendo el número de ciclos de la enfermedad y en consecuencia, la severidad. Esto también tendrá un efecto en el número de aplicaciones necesarias dentro del ciclo del cultivo y en el costo de producción (Enciso-Maldonado et al., 2021b).
Este trabajo ha demostrado que la aplicación de los programas de rotación de premezclas de fungicidas disminuye la severidad de RAS e incrementa el rendimiento de granos de soja. Finalmente, se observó que los programas que incluyeron cuatro aplicaciones no tuvieron un efecto aditivo sobre la disminución de la severidad ni en el incremento del rendimiento. Futuros trabajos deberían considerar el beneficio económico de reducir el número de aplicaciones y realizar una siembra temprana.












 uBio
uBio 



