INTRODUCCIÓN
El tejido miocárdico auricular fibrótico está compuesto de miocitos desorganizados y colágeno en un espacio extracelular expandido. Existe amplia evidencia de que la fibrosis de la pared auricular desempeña un papel central en la estabilización de los circuitos reentrantes que inician y mantienen la arritmia auricular, específicamente la fibrilación auricular (FA) 1-4. El contenido y la distribución del tejido fibroso auricular en pacientes con FA están relacionados no sólo con los mecanismos de la FA sino también con el riesgo de complicaciones cardiovasculares y fracaso terapéutico 3-5. Las imágenes clínicas de fibrosis prometen proporcionar información útil para guiar el tratamiento de la FA, mientras que una mejor comprensión de cómo prevenir la fibrosis puede abrir nuevos objetivos para el desarrollo de nuevos enfoques de tratamiento 1-5. Los sistemas de mapeo auricular actualmente disponibles pueden registrar información de activación eléctrica, ubicación del catéter y de la lesión, y son capaces de rastrear los catéteres en tiempo real. La combinación de esta información eléctrica y de navegación con la anatomía tridimensional explícita de la aurícula izquierda (AI) y las venas pulmonares (VP) debería aumentar la eficacia de los procedimientos de ablación de la FA.
En el tejido miocárdico, los fibroblastos son células pequeñas con forma de huso que comprenden la estructura de la matriz extracelular. Aunque los fibroblastos constituyen hasta el 75% de las células cardíacas en número, sólo representan entre el 10% y el 15% en masa 6. Se puede considerar que la fibrosis auricular consta de 2 tipos principales: fibrosis reactiva y reparadora 7-10. Primero, en la fibrosis reactiva o intersticial hay proliferación de fibroblastos y diferenciación al fenotipo de miofibroblastos secretores, y acumulación de colágeno en el espacio perivascular y el perimisio que rodea los haces de músculo cardíaco. En segundo lugar, la fibrosis reparadora o de reemplazo ocurre cuando el tejido fibroso reemplaza zonas de células musculares muertas, como la cicatriz de un infarto de miocardio 7,9. Este tipo de fibrosis auricular puede ser en gran medida irreversible y se asocia con una muerte celular extensa y regiones de fibrosis que interrumpen los haces de músculos produciendo claras barreras de conducción longitudinales 11,12. Estos diferentes tipos de fibrosis no son necesariamente excluyentes entre sí y muchos pacientes pueden tener combinaciones de fibrosis intersticial y de reemplazo en las aurículas. La señalización profibrótica implica un conjunto complejo de vías interactivas y sistemas de señalización molecular 13-16. Los principales receptores de membrana celular profibróticos incluyen los del factor de crecimiento del tejido conectivo, los receptores de angiotensina II tipo 1, el factor de crecimiento derivado de plaquetas y el factor de crecimiento transformante beta. La inflamación y sus numerosas citocinas y mediadores celulares asociados también son muy eficaces para liberar y activar moléculas profibróticas y provocar fibrosis 17-21.
Las células del miocardio y los fibroblastos pueden desarrollar uniones eléctricas de baja resistencia y modular la actividad eléctrica de cada uno en sistemas de cultivos (22, 23). El grado de interacción y su importancia depende del número de fibroblastos acoplados a cada célula miocárdica y del grado de acoplamiento, así como del tamaño relativo de las células miocárdicas al tamaño de los fibroblastos 24-27. Un acoplamiento significativo en la unión cardiomiocito-fibroblasto puede mejorar la despolarización de la fase 4 y promover latidos ectópicos 6 y también puede retardar la conducción de impulsos y promover el desarrollo de arritmias reentrantes, especialmente FA 23. Por lo tanto, en el presente artículo analizamos los mecanismos y el papel de la fibrosis miocárdica auricular obtenidos por resonancia magnética cardíaca, resonancia magnética por imágenes con realce tardío con gadolinio (LGE-RMN) en la evaluación de la FA y de su adecuado manejo terapéutico invasivo. Para poder realizarlo, hemos buscado en las bases de datos MEDLINE, PUBMED, SCOPUS y Web of Science utilizando las siguientes palabras claves: miocardiopatía auricular, fibrosis en fibrilación auricular, resonancia magnética por imágenes con realce tardío con gadolinio. Más de 5.000 estudios relevantes fueron individualizados; sin embargo, utilizamos los artículos originales, los metaanálisis y las revisiones sistemáticas que específicamente analizaban el papel de la fibrosis miocárdica auricular mediante resonancia magnética cardíaca, y LGE-RMN en la evaluación de la fibrosis y la remodelación del sustrato anatómico auricular en el desarrollo de la FA para su mejor manejo terapéutico invasivo.
Mecanismos fisiopatológicos de la fibrosis auricular en la FA
Los mecanismos de la fibrosis miocárdica son, sin duda, multifactoriales. Es el resultado de una combinación de varios factores que incluyen la predisposición genética, la exposición a toxinas y patógenos, inflamación, la isquemia microvascular y la modulación anormal de las respuestas inmunes y metabólicas 27-29. Se observó que la fibrosis miocárdica puede resultar de inflamación, así como isquemia microvascular y se pueden observar patrones reactivos o reparativos en estudios histológicos experimentales en humanos y animales 28. El estiramiento mecánico también es un importante activador de fibroblastos y un estímulo para la fibrosis 17. La insuficiencia mitral funcional y la dilatación rápida de la AI son consecuencias comunes de la FA asociada a fibrosis auricular 18, y el estiramiento auricular es probablemente un estímulo profibrótico central en muchos modelos de estudio. La síntesis de colágeno comienza en el retículo endoplasmático con la producción de procolágeno que es un precursor del colágeno 19-21. El colágeno tipo I, que constituye del 80% al 90% del colágeno en el tejido fibroso, se produce a partir de cadenas alfa 1 y alfa 2 de procolágeno. Cada molécula de procolágeno-1 consta de dos cadenas alfa 1 y una cadena alfa 2, que forman una hélice alfa central enrollada con proteinasa C-terminal de procolágeno y proteinasa N-terminal de procolágeno. El procolágeno-3 consta de tres cadenas alfa de procolágeno-3. El procolágeno se secreta desde la célula al espacio extracelular y las moléculas de colágeno maduras se forman mediante el autoensamblaje terminal-terminal. El paso final en la formación de colágeno es el entrecruzamiento oxidativo mediante la lisil oxidasa y enzimas relacionadas similares a la lisil oxidasa 19-21. Aunque una amplia gama de proteínas se expresa en la matriz extracelular y están involucradas en la respuesta profibrótica, se sabe relativamente poco sobre sus funciones en la fibrosis auricular y sobre si manipular su expresión o función puede ser útil en el manejo terapéutico.
Los fibroblastos proliferan y se diferencian en un fenotipo secretor, pero no proliferativo llamado miofibroblasto cuando son activados por ciertos estímulos profibróticos 7. La fuente de estas últimas células en el miocardio remodelado no se comprende claramente, con evidencia de contribuciones de fibroblastos residentes, células derivadas de la médula ósea, células endoteliales, células perivasculares y pericitos 7. El proceso fibrótico es complejo e implica una mayor producción y actividad de una variedad de proteínas de la matriz extracelular secretadas por los fibroblastos. Estas proteínas incluyen fibronectina, procolágeno, agentes reticulantes de colágeno como la lisil oxidasa y enzimas como las metaloproteinasas de matriz e inhibidores tisulares de las metaloproteinasas de matriz (6, 7). Se demostró en estudios histopatológicos la existencia de importante reemplazo intersticial y fibrosis perivascular en el miocardio que también son muy bien visualizados por mapeo endocárdico tridimensional (figura 1).
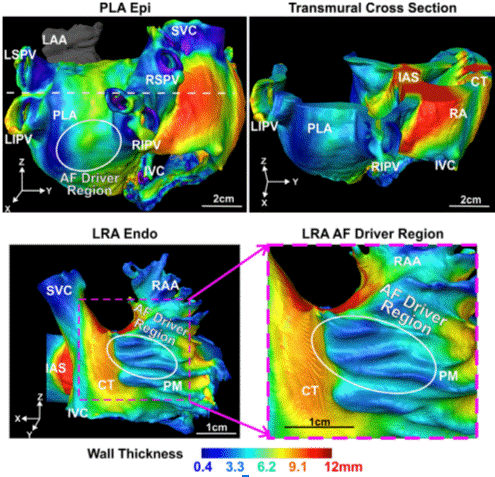
Figura 1 Visualización de fibrosis transmural por mapeo endocárdico tridimensional. Endo: Endocardio. Epi: epicardio. LIPV: Vena pulmonar inferior izquierda. PLA: Aurícula posterior izquierda. Reimpreso con autorización de Zhao J, Hansen BJ, Wang Y, Csepe TA, Sul LV, Tang A, et al. Three-dimensional Integrated Functional, Structural, and Computational Mapping to Define the Structural “Fingerprints” of Heart-Specific Atrial Fibrillation Drivers in Human Heart Ex Vivo. J Am Heart Assoc. 2017;6:e005922. DOI: 10.1161/JAHA.117.005922 (23)
Estos tejidos fibrosos en sustrato isquémico o no isquémico pueden empeorar la anisotropía no uniforme, lo que lleva a un retraso en la conducción y un bloqueo de la conducción unidireccional, generando circuitos reentrantes y arritmias cardíacas. También se demostró que el aumento de la fibrosis miocárdica era la causa de la propagación anisotrópica no uniforme y de los electrogramas fraccionados 29-31. Se demostró que la mayoría de los nuevos frentes de ondas reentrantes se iniciaron en la zona epicárdica, seguida por una línea de bloqueo de conducción paralela a la orientación de las fibras epicárdicas. Estos hallazgos sugieren la importancia de una mayor fibrosis y anisotropía tisular en el inicio de la reentrada. La conducción anisotrópica juega un papel importante en el desarrollo de diversos tipos de arritmias auriculares 30-32. Se ha demostrado que la conducción anisotrópica y el bloqueo pueden resultar de la separación de las fibras musculares por el tejido conectivo en la zona del borde epicárdico. También se informó que la mayor incidencia de arritmias auriculares con la edad puede deberse al desarrollo de extensos tabiques colágenos que dividen las fibras miocárdicas. La fibrosis intersticial y las amplias bandas de cicatrización fueron otra complejidad estructural característica de la conducción lenta y la activación retardada de la despolarización. Un aumento de tejidos fibrosos entre las fibras y los haces musculares puede empeorar la anisotropía no uniforme y promover el desacoplamiento eléctrico. En este contexto, la propagación del impulso y la despolarización a través del tejido auricular pueden fallar en la dirección transversal pero no en la propagación longitudinal, lo que resulta en un bloqueo de la conducción unidireccional. Por lo tanto, la zona distal a la línea de bloqueo puede ser activada por el frente de onda transversal que se propaga lentamente, lo que permite un retraso más prolongado para que las fibras proximales recuperen la excitabilidad para desarrollar la reentrada y la FA 30-32.
Se ha demostrado que los cambios fibróticos en el miocardio auricular están altamente asociados con el inicio y mantenimiento de la FA. Según las directrices de la Sociedad Europea de Cardiología 33 y un documento de consenso publicado recientemente sobre miocardiopatía auricular 34, la comprensión de la FA está cambiando desde una única alteración del ritmo hacia el concepto de un fenómeno combinado de ritmo más miocardiopatía auricular que está bien interconectado. El documento de consenso de expertos de la EHRA/HRS/APHRS/SOLAECE sobre miocardiopatías auriculares: definición, caracterización e implicaciones clínicas, caracteriza esta miocardiopatía auricular como “cualquier complejo de cambios estructurales, arquitectónicos, contráctiles o electrofisiológicos que afectan a las aurículas con potencial para producir manifestaciones clínicamente relevantes” 34.
Observaciones obtenidas mediante métodos de diagnóstico auxiliares en los últimos años han conducido a nuevos conocimientos mecanicistas en la FA. La obtención de imágenes de la fibrosis auricular mediante LGE-RMN mejorada puede ser una opción para identificar a los pacientes con riesgo de FA antes del inicio de la arritmia (figura 2). Como hallazgo plausible y muy interesante, Cochet et al35 demostraron cambios estructurales significativos en las aurículas de individuos sin FA. Esta miopatía auricular puede ser un precursor del desarrollo de FA al demostrar que las alteraciones auriculares fibróticas ya están presentes en las primeras etapas de la FA 35. Esos conocimientos mecanicistas pueden proporcionar la hipótesis para futuros estudios de cohorte y de investigación que evalúen la progresión y la reversibilidad del remodelado fibrótico auricular mediante procedimientos intervencionistas.
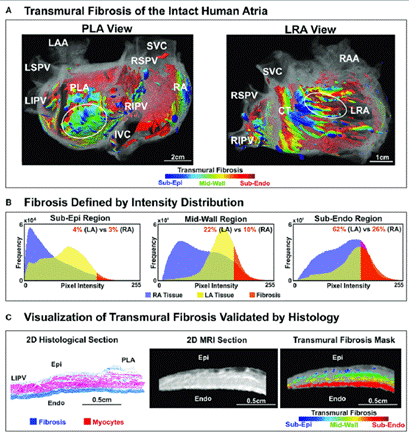
Figura 2 A. Fibrosis transmural de la aurícula humana intacta en PLA y LRA. Distribución de fibrosis tridimensional (3D) en toda la aurícula humana. B. Distribución de la fibrosis en el volumen auricular visualizada transmuralmente y definida por distribución de intensidad. C. La transmuralidad de la fibrosis se muestra validada por histología. Los óvalos blancos indican las ubicaciones de las regiones del controlador AF definidas por el mapeo óptico. TC: cresta terminal. Endo: endocardio; Epi: epicardio. VCI/VCS: vena cava inferior/superior. LA/RA: aurícula izquierda/derecha. LAA/RAA: orejuela auricular izquierda/derecha. ALR: aurícula lateral derecha. LSPV/LIPV/RSPV/RIPV: vena pulmonar superior izquierda/inferior izquierda/superior derecha/inferior derecha. PLA: aurícula izquierda posterior. Reimpreso con autorización de Zhao J, Hansen BJ, Wang Y, Csepe TA, Sul LV, Tang A, et al. Three-dimensional Integrated Functional, Structural, and Computational Mapping to Define the Structural “Fingerprints” of Heart-Specific Atrial Fibrillation Drivers in Human Heart Ex Vivo. J Am Heart Assoc. 2017;6:e005922. DOI: 10.1161/JAHA.117.005922 (23).
La decisión de tratar de forma invasiva a un paciente con FA se basa actualmente en los síntomas, el comportamiento temporal de la arritmia, la edad y las comorbilidades asociadas con la arritmia 36. Dado que se ha demostrado que la fibrosis auricular con realce tardío de gadolinio (LGE-RMN) es un poderoso predictor del resultado clínico al corregir otros factores de confusión, puede guiar con éxito la toma de decisiones terapéuticas 36.
Mediante mapas de potencial transmembrana epicárdico en dos instantes de tiempo en los modelos auriculares y dependiendo de la ubicación, intensidad y extensión de la fibrosis y sustratos fibróticos de la aurícula izquierda se pueden clasificar en estadios I a IV de Utah (figura 3). Para los pacientes con clases Utah III/IV con fibrosis difusa y extensa, se debe considerar un enfoque convencional no invasivo porque las probabilidades de ausencia de la fibrilación auricular a largo plazo son muy bajas después de la ablación con catéter de la fibrilación auricular 36.
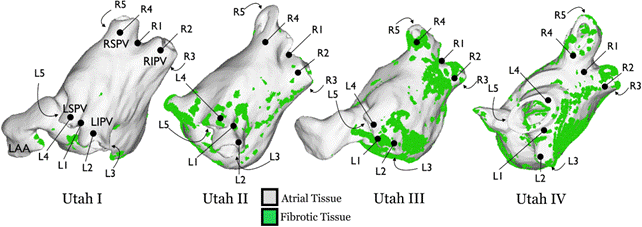
Figura 3 Distribuciones específicas de cada paciente de la fibrosis de la aurícula izquierda para sustratos en los estadios I a IV de Utah. Las ubicaciones de estimulación en las venas pulmonares (PV) izquierdos (L1-L5) y derechos (R1-R5) se indican para cada sustrato. Las ubicaciones anatómicas para la PV superior izquierda (LSPV), la PV inferior izquierda (LIPV), la PV superior derecha (RSPV), la PV inferior derecha (RIPV) y el apéndice LA (LAA) se indican en el sustrato más a la izquierda; Todos los sustratos se presentan en orientaciones idénticas. Reimpreso con autorización de McDowell KS, Zahid S, Vadakkumpadan F, Blauer J, MacLeod RS, Trayanova NA. Virtual Electrophysiological Study of Atrial Fibrillation in Fibrotic Remodeling. PLoS ONE 2015;10(2): e0117110. doi:10.1371/journal.pone.0117110 (22).
Además, la LGE-RMN previa a la ablación también puede ayudar a asesorar a los pacientes sobre el resultado esperado de la ablación con catéter y también sobre las opciones de tratamiento alternativas 36. Los enfoques de tratamiento y las medidas terapéuticas para reducir el riesgo de FA, como el control de la presión arterial, la reducción del consumo de alcohol, el ejercicio moderado y la optimización de otras comorbilidades, ya han demostrado ser eficaces en ciertos grupos de pacientes. Estos enfoques clínicos y medidas terapéuticas pueden disminuir el desarrollo de FA al reducir la carga fibrótica auricular 37. La posibilidad de visualizar y cuantificar un sustrato auricular mediante LGE-RMN ofrece la posibilidad de determinar el efecto de las intervenciones anteriores mediante la documentación de la progresión o reversión del remodelado auricular. La evaluación de la fibrosis auricular también puede tener el potencial de aclarar aún más el papel de los efectos antiarrítmicos de los fármacos no antiarrítmicos en términos de terapia previa, así como las evidencias clínicas de los cambios de estilo de vida 38. La selección adecuada de los pacientes es obligatoria para investigar los efectos beneficiosos de varios fármacos en subgrupos específicos de pacientes con fibrosis temprana leve en quienes es muy probable que se desarrolle FA. Cada vez hay más pruebas de una asociación entre FA, fibrosis auricular y accidentes cerebrovasculares isquémicos. El ictus debido a una embolia arterial de origen cardíaco es una complicación terrible. Se ha demostrado que la fibrosis detectada mediante LGE-RMN está asociada con el accidente cerebrovascular 39. También se demostró que la carga de fibrosis previa a la ablación es un factor de riesgo significativo para la presencia de ecocontraste espontáneo en la ecocardiografía transesofágica. Este último hallazgo añade poder predictivo adicional a las puntuaciones de riesgo ya establecidas 40. Por otro lado, existen ciertos desacuerdos sobre la asociación entre FA e Ictus. El ensayo ASSERT 41 demostró que los eventos de accidente cerebrovascular tenían sólo una correlación muy pobre con el momento de los episodios de FA 41. Además, se demostró que el riesgo de accidente cerebrovascular podría estar asociado de forma independiente con la remodelación fibrótica estructural en ausencia de FA en pacientes con una rara enfermedad autosómica recesiva, a saber, la miocardiopatía auricular dilatada 42. Consideraciones adicionales sugieren un posible estado procoagulativo subyacente, mediado por vías de señalización del receptor activado por proteinasa, que por un lado podría predisponer a eventos tromboembólicos y, por otro, contribuir a la fibrosis auricular. Teniendo en cuenta estos hallazgos, el riesgo de accidente cerebrovascular en la FA puede considerarse como un continuo en el que los factores de riesgo acumulativos deben evaluarse en detalle y el valor adicional de la evaluación de la fibrosis debe investigarse más a fondo en ensayos controlados prospectivos.
La fibrosis auricular se considera un factor clave en el desarrollo de la FA basada en la insuficiencia cardíaca 43. Con la utilización de LGE-RMN se demostró que los pacientes con FA con insuficiencia cardíaca presentan un mayor grado de fibrosis auricular, lo que destaca aún más una relación causal entre la disfunción del VI y la remodelación estructural auricular que conduce al inicio y mantenimiento de la FA. Dado que hay poca información sobre estudios en humanos que evalúen el papel de la fibrosis auricular en el contexto de la insuficiencia cardíaca, se justifica realizar más investigaciones clínicas. Se deben considerar estudios de imágenes con LGE-RMN para analizar la fibrosis auricular izquierda y su progresión antes y después de la ablación inicial y repetida con catéter de FA 44. Estos estudios proporcionan resultados prometedores para visualizar el comportamiento temporal de la fibrosis auricular después de la ablación restando las cicatrices posteriores a la ablación de la extensión total del tejido auricular fibrótico inicial. Se demostró que los pacientes sin recurrencia de FA después de la ablación con catéter de radiofrecuencia mostraron una reducción significativa en la carga de fibrosis de la AI en estudios de seguimiento con LGE-RMN 45.
La fibrosis auricular refleja el sello distintivo de la remodelación estructural de la aurícula, por lo tanto, la evaluación de los cambios de las alteraciones fibróticas puede arrojar algo de luz y dar nuevos conocimientos sobre las estrategias de tratamiento de la FA en caso de recurrencia de la FA después de la ablación con catéter 45. El realce tardío de gadolinio aumenta nuestra comprensión de la relación causal y temporal de la remodelación eléctrica y estructural en el curso natural de la FA. Dado que el tejido fibrótico produciría una señal de bajo voltaje, el mapeo de voltaje mediante el muestreo de señales eléctricas del tejido auricular es el estándar de oro para evaluar y estadificar el alcance de la fibrosis auricular. Jadidi AS et al46 informaron una correlación de los datos de resonancia magnética y las propiedades electrofisiológicas que describen un voltaje bipolar más bajo en áreas fibróticas en comparación con el tejido no fibrótico. En este contexto, debemos ser cautelosos y tener en cuenta que la conducción lenta inducida por alteraciones funcionales, es decir, cambios de conexinas, puede simular un bajo voltaje sin estar relacionado con la remodelación fibrótica.
La primera comparación punto por punto de la fibrosis, evaluada mediante LGE-RMN, y el voltaje endocárdico, que demuestra que los niveles crecientes de LGE se correlacionan con voltajes más bajos, se proporcionó hace unos 10 años atrás 47. Los niveles mejorados de LGE-RMN de 5 desviaciones estándar por encima del valor conjunto de la sangre se correlacionaron con 0,38±0,28 mV, lo que indica que 0,05 mV como umbral arbitrario podría subestimar la extensión de las áreas fibróticas. Además, se observó que las cicatrices inducidas por la ablación revelan un voltaje de 0,3 a 0,6 mV; un umbral de ≤0,05 podría subestimar significativamente el alcance de la lesión por ablación 47. Son datos muy interesantes que tenemos que tener en cuenta para fijar valores de normalidad adecuados. Este trabajo 48 proporcionó la primera validación histopatológica de LGE-RMN mejorada y mapeo de voltaje endocárdico para la definición de cicatrización auricular con lesión por ablación aguda y crónica al proporcionar umbrales de intensidad de señal para ambos tipos de ablación. Por lo tanto, los valores de voltaje de corte específicos del paciente para la fibrosis deben estar bien establecidos y se deben realizar más estudios de validación histopatológica para la fibrosis auricular. Los múltiples métodos auxiliares de diagnóstico necesarios para obtener el mejor rendimiento en la orientación terapéutica del manejo de la FA muestran cuán complejo es el manejo terapéutico de la FA 48. La necesidad de combinar varias modalidades de imágenes como fluoroscopia, mapeo electroanatómico 3D, LGE-RMN y guía por ecocardiografía intracardíaca, para optimizar los resultados de la ablación de la FA implica dificultades técnicas para realizar este enfoque terapéutico. Por otro lado, la necesidad de combinar diferentes técnicas de ablación de FA, a saber, ablación circunferencial, lineal y dirigida de electrogramas fraccionados complejos, para mejorar la tasa de éxito demuestra la complejidad del sustrato electrofisiológico en la FA. Actualmente, el LGE-RMN ofrece la opción de evaluar la estructura auricular en 3D por un lado, y por otro, el mapeo electroanatómico 3D con superficie endocárdica proporcionado por el mapeo de voltaje puede identificar de manera confiable la ubicación y la extensión transmural de los cambios fibróticos. Debido a la complejidad del sustrato anatómico de la FA se están investigando otros métodos para evaluar los cambios estructurales 36.
Uso del LGE-RMN en las imágenes de fibrosis auricular
El realce tardío con contraste extracelular a base de gadolinio se basa en un lavado retardado del contraste en el tejido miocárdico con mayor espacio extracelular. Dado que el tejido auricular fibrótico está compuesto de células musculares desorganizadas y colágeno, y tiene un espacio extracelular expandido, es más notorio con contrastes extracelulares 49. El agente de contraste se difunde rápidamente fuera de los capilares después de la administración intravenosa. Dado que el agente no puede atravesar células con membranas intactas, se acumula en el espacio extracelular. Esto conduce a una acumulación de contraste en las áreas fibróticas en pacientes con fibrosis auricular. Por lo tanto, el tejido fibrótico se visualiza con mayor intensidad de señal en comparación con el tejido miocárdico sano en las resonancias magnéticas nucleares ponderadas en T1 49,50.
El estudio DECAAF 36 fue un estudio multicéntrico realizado en 15 centros clínicos que adoptaron el protocolo LGE-RMN para la fibrosis auricular izquierda en su práctica clínica. En este estudio, los sujetos asignados para imágenes de fibrosis auricular se sometieron a una LGE-RMN tridimensional (3D) junto con una angiografía por resonancia magnética con contraste e imágenes cinematográficas para definir la anatomía de la AI y las VP 36. Para realizar la investigación, los estudios de RMN podrían realizarse en escáneres de resonancia magnética de 1,5 T y 3 T utilizando bobinas cardíacas especializadas o bobinas receptoras convencionales de matriz en fase para el cuerpo y la columna. Se adquirieron imágenes LGE de alta resolución de la aurícula izquierda de 15 a 30 minutos después de la administración de contraste utilizando una secuencia de pulso de eco de gradiente activada por electrocardiograma (ECG) con saturación de grasa preparada con inversión-recuperación (IR) 3D, navegación guiada por respiración y ECG. La ventana de aceptación del navegador normalmente se estableció en ±3 mm. La adquisición de datos para la secuencia LGE solo está activa si el desplazamiento de la AI es <1,5 mm desde el inicio 36. Además, para minimizar el efecto del movimiento de la AI, los datos de imágenes se adquirieron durante la fase diastólica de la AI con la adquisición de datos limitada al 15% del ciclo cardíaco. El tiempo de eco de la exploración LGE se seleccionó preferentemente para reducir la intensidad de la señal de los vóxeles de tejido graso de volumen parcial y para permitir una mejor delimitación de la pared auricular izquierda. El valor del tiempo de inversión (TI) para la exploración LGE-RMN se identificó mediante una exploración TI-scout. El tiempo de exploración típico para los estudios LGE-RMN es de 8 a 12 minutos, según el ritmo del paciente y el patrón respiratorio 36. Las contraindicaciones para el protocolo de fibrosis auricular con LGE-RMN son principalmente las mismas contraindicaciones que para las resonancias magnéticas convencionales: dispositivos de ritmo cardíaco, claustrofobia severa y otras contraindicaciones estándar para la resonancia magnética a criterio del médico, como válvulas cardíacas protésicas o material paramagnético en el cerebro. o en los ojos. Aunque la función renal disminuida no es una contraindicación, para minimizar el riesgo de esclerosis sistémica nefrogénica, se excluyó del protocolo de imágenes de fibrosis a los pacientes con una tasa de filtración glomerular estimada <30 ml/min 36.
En el protocolo DECAAF, los datos de la resonancia magnética fueron evaluados y procesados por dos operadores expertos utilizando el software de análisis y procesamiento de imágenes Corview (Marrek, Salt Lake City, Utah) 36. La segmentación de la pared de la aurícula izquierda resultante incluyó la extensión 3D de la pared de la AI y las regiones antrales de las 4 venas pulmonares. Para la evaluación de la fibrosis, un algoritmo seleccionó automáticamente umbrales de intensidad asumiendo las distribuciones de intensidad gaussianas para el tejido fibrótico (vóxeles mejorados) y el miocardio "normal". El umbral se seleccionó basándose en la media estimada y la desviación estándar del miocardio "normal". El operador validó este umbral inspeccionando visualmente la correspondencia entre los vóxeles mejorados en imágenes LGE-RMN y los vóxeles detectados por el algoritmo utilizado 36. En los casos de discrepancia, el operador ajustó el umbral para reflejar una correspondencia precisa. Los valores de umbral de intensidad típicos estaban en el rango de 2 a 4 DE. El uso del mismo valor umbral para todos los pacientes no es factible porque el contraste entre el miocardio normal y fibrótico en LGE-RMN de la aurícula izquierda depende de múltiples factores. Al buscar sustratos auriculares mediante LGE-RMN, se puede utilizar el siguiente código de colores para la visualización 3D de la fibrosis de la aurícula izquierda: el tejido sano se representa en azul; cualquier otro tejido con realce tardío LGE se representa en verde y amarillo. Además, se puede aplicar una máscara de tabla de búsqueda de colores para diferenciar mejor el tejido mejorado del no mejorado. Las imágenes procesadas se asignan a 1 de los 4 estadios establecidos en Utah (Figura 2), sobre la base del realce de la pared de la aurícula izquierda como porcentaje del volumen total de la pared: estadio I, definido como <10 %, estadio II ≥10 a < 20%, estadio III ≥20 a <30% y estadio IV ≥30% 36.
La cuantificación de la fibrosis auricular derecha mediante LGE-RMN se puede realizar de manera similar 51. Es de destacar que la corrección de la falta de homogeneidad de la intensidad de la imagen y la segmentación precisa de la pared auricular son más difíciles para la aurícula derecha que para la izquierda debido a la proximidad a las bobinas receptoras y a una trabeculación significativa de la pared libre de la aurícula derecha. Se ha demostrado claramente que la RMN con realce tardío con gadolinio identifica áreas de fibrosis y cicatrices en la aurícula izquierda antes y después de la ablación 52. Se ha demostrado el valor predictivo de la fibrosis del tejido auricular antes de la ablación para predecir la recurrencia de arritmias después de la ablación. Se ha sugerido que la cantidad de cicatrices inducidas por la ablación es un predictor importante de la recurrencia de la arritmia 52. Existen diferentes técnicas que se pueden utilizar para obtener imágenes con LGE-RMN, sin embargo, es bueno saber que existe cierto acuerdo sobre las técnicas de RMN utilizadas por los diferentes centros clínicos. Las técnicas utilizadas para la evaluación de la fibrosis de la AI y la cicatriz postablación son similares a las utilizadas para el estudio DECAAF 36. Todos los grupos utilizan secuencias de pulsos de eco de gradiente de navegación respiratoria activadas por ECG con preparación de IR y saturación de grasa. La principal diferencia entre los centros que realizan la evaluación de la fibrosis de la AI es cómo se analizan las imágenes LGE para cuantificar la fibrosis de la AI. La mayoría utilizó enfoques manuales o semimanuales para segmentar las paredes de AI a partir de imágenes LGE. Además, para visualizar mejor la superficie endocárdica auricular, se puede utilizar una angiografía por resonancia magnética con contraste adquirida en las mismas fases cardíaca y respiratoria que la LGE-RMN 3D para simplificar la segmentación de la superficie endocárdica de la AI 36. Esta es una sección de imágenes adquiridas que depende del operador. Por lo tanto, algunos laboratorios cuantifican la fibrosis de la AI analizando la distribución de la intensidad de la señal de las paredes segmentadas de la AI y confiando en la decisión de un operador experto para seleccionar los umbrales de detección, que normalmente oscilan entre 2 y 4 DE por encima de la media para el miocardio normal 53. Otros centros utilizan el conjunto de sangre de la AI como referencia para identificar vóxeles de pared de AI mejorados que es el método de relación de intensidad de la imagen propuesto por Khurram et al. 54, éste normaliza la intensidad de la pared de la AI por el valor medio de la intensidad de la sangre. Este enfoque puede reducir la variabilidad intraoperador e interoperador en la cuantificación de la fibrosis de la AI. La discrepancia en los umbrales de la relación de intensidad de la imagen entre diferentes centros puede atribuirse al hecho de que estos laboratorios han utilizado escáneres de resonancia magnética con diferentes intensidades de campo, diferentes agentes de contraste y diferentes intervalos de tiempo entre la administración de contraste y las imágenes adquiridas por LGE-RMN. Estos y varios otros factores pueden cambiar la relación entre las intensidades de las imágenes del miocardio y la sangre. Además, esta relación depende del valor del tiempo de inversión, la frecuencia y el ritmo cardíaco durante la adquisición de la resonancia magnética, la tasa de eliminación de contraste específica del paciente, el índice de masa corporal, el hematocrito en sangre y el nivel de oxigenación. A pesar de estos inconvenientes, la variabilidad interobservador demostró una alta reproducibilidad 54. Algunos centros han estudiado y bien informado la variabilidad entre observadores de la evaluación de la fibrosis de AI. Se han informado coeficientes de correlación entre observadores en el rango de 0,79 a 0,97, lo que demuestra una alta reproducibilidad con respecto a la segmentación de la pared de la AI y la cuantificación de la fibrosis 53. Estos altos coeficientes de correlación para la variabilidad del observador son un reflejo de la experiencia en la adquisición de exploraciones LGE-RMN de buena calidad, segmentación precisa de la pared de la AI y cuantificación reproducible de la fibrosis en centros de alto volumen. Los escáneres con mayor intensidad de campo podrían lograr una mejor resolución espacial. Por otro lado, debido a la resolución espacial limitada de las exploraciones LGE-RMN, sigue siendo un desafío diferenciar entre el espesor transmural y parcial de la fibrosis auricular izquierda. Además, la adquisición de datos para LGE-RMN de las paredes auriculares no se puede realizar dentro de un único ciclo cardíaco. Por lo tanto, el proceso de adquisición de datos debe activarse mediante ECG y limitarse a menos del 20% de los intervalos RR con ajuste de la duración y la posición de la ventana de adquisición según la frecuencia y el ritmo cardíacos. El escáner debe detectar con precisión el complejo QRS para garantizar que los datos se adquieran al mismo tiempo que el ciclo cardíaco para una activación adecuada 55. La adquisición de datos se realiza en diástole auricular para minimizar los artefactos de movimiento y ampliar la duración de la adquisición de datos. A diferencia de los pacientes en ritmo sinusal con intervalos RR estables, las imágenes de la AI en FA o latidos prematuros frecuentes siguen siendo un desafío. Para estos pacientes, la adquisición de datos debe realizarse poco después de la onda R y la duración de la ventana de adquisición de datos debe acortarse al 10% o 12% del intervalo RR promedio 54. Por otro lado, dado que las imágenes de apnea convencionales con apneas prolongadas suelen ser un desafío para los pacientes con enfermedad cardiopulmonar, se aplica un algoritmo de sincronización respiratoria para minimizar los artefactos provocados por el movimiento respiratorio 56. En un análisis retrospectivo de los datos del estudio DECAAF 57, se identificaron errores del tecnólogo a cargo como la fuente principal (62%) de exploraciones de mala calidad. También se demostró que el 31% de los escaneos de mala calidad estaban relacionados con el paciente y el 7% eran resultado de problemas de hardware. Con respecto a los problemas relacionados con el paciente, la arritmia y los patrones respiratorios irregulares fueron causantes de una mala calidad de imagen con la misma incidencia del 40%. Tanto la calidad general de la imagen como la visibilidad de la fibrosis/cicatrices de la LGE-RMN de la aurícula izquierda dependen de la frecuencia cardíaca y la regularidad del ritmo cardíaco 57. Vijayakumar S et al. 58 han demostrado una visibilidad de las cicatrices significativamente menor en pacientes con una frecuencia cardíaca superior a 100 latidos por minuto. Higuchi K et al. 59 estudiaron recientemente la distribución espacial de LGE-RMN de la AI en pacientes con FA. Realizaron exploraciones LGE-RMN a 160 pacientes con FA con una edad media de 66±11 años antes de la ablación de la FA. La distribución general del LGE se resumió como un histograma de frecuencia espacial utilizando un atlas de forma de AI. Sus datos también se compararon entre FA paroxística (87 pacientes) y FA persistente (73 pacientes). Los autores encontraron que la cobertura del LGE (%) en cada subregión fue la siguiente: 41,8±18,9% en el antro de la vena pulmonar izquierda, 27,1±16,7% en la pared lateral izquierda, 25,8±15,3% en la pared posterior, 19,7±15,3% en la pared anterior, 17,1±15,0% en el antro de la VP derecha y 12,0±13,2% en la pared del tabique. El LGE se distribuyó de manera heterogénea en la AI y se encontró con la frecuencia más alta en la pared posterior cerca del antro de la VP inferior izquierda según el histograma del LGE. Una comparación de la FA paroxística con la FA persistente sugiere que el LGE era más esperado en la FA persistente en comparación con la FA paroxística, particularmente con una extensión en la pared posterior y anterior. Por lo tanto, concluyeron que el LGE en AI estaba distribuido de manera heterogénea. El LGE se distribuyó ampliamente en el antro de la VP inferior izquierda cerca del lado de la pared posterior y se extendió a las paredes posterior y anterior con progresión de la FA 59.
Platonov PG et al. 60, observaron que la pared posterior de la AI en el nivel inferior de la VP era la única área de fibrosis significativa dependiente del tiempo en un estudio histológico de corazones humanos autopsiados. Tanaka K et al.61 encontraron que la fibrosis de la AI en la pared posterior y el antro de la VP desempeñaba un papel importante en el mantenimiento de la FA en un estudio experimental utilizando un modelo de FA en ovejas con insuficiencia cardíaca 61. Utilizando pacientes con FA crónica sometidos a cirugía de válvula mitral y control mediante autopsia, Corradi D et al.62 también demostraron que la fibrosis ocurre más en la pared posterior de la AI que en la orejuela auricular izquierda. Higuchi K et al59 supusieron que la distribución heterogénea del LGE en los pacientes de su estudio en regiones particulares de la AI se deriva de las estructuras externas alrededor de la AI. Podría ocurrir una mayor remodelación de la AI debido a una presión mecánica o una fricción con la aorta, el esófago y el cuerpo vertebral. La proximidad de la pared posterior de la AI y la aorta descendente se puede reconocer en el nivel del ostium de la VP inferior izquierda, donde puede ocurrir fricción mecánica. El cuerpo vertebral y la aorta ascendente se adhieren más a la pared de la AI dilatada a medida que avanza la FA y aumentan la remodelación en el área de inserción, es decir, la pared anterior y posterior de la AI. Esa puede ser una explicación de por qué el LGE se disemina en la pared posterior y ocurre en la pared anterior cuando progresa de FA paroxística a FA persistente 59.
Lachman N et al. 63 afirmaron que la tensión de presión distinta de la fricción mecánica a la pared de la AI también varía debido a las diferentes estructuras pericárdicas, lo que resulta en heterogeneidad del LGE. Hunter et al. 64, utilizaron tomografías computarizadas 3D para estimar el estrés de presión de la pared en pacientes con FA persistente. La tensión de la pared fue particularmente común alrededor de los ostium de la VP izquierda y la cresta de la orejuela auricular izquierda. Nakahara S et al. 65 demostraron que las áreas de activación de pivote durante la FA que eran núcleos de activación localizada en la FA se encontraban en la pared anterior, el antro de la VP izquierda y la pared posterior donde se unían estructuras externas como la aorta y el cuerpo vertebral. Cuando Higuchi K et al. 59 compararon la distribución del LGE en pacientes con FA paroxística y FA persistente, no se observaron diferencias en el antro de las VP izquierdas ni en la pared lateral izquierda. Aunque se observó una distribución significativamente mayor del LGE en pacientes con FA persistente en otras áreas, especialmente en la pared posterior y anterior. Este resultado sugiere que el LGE era común en el antro de la VP izquierda o en la pared lateral izquierda. Esto se observó incluso en pacientes con FA paroxística con miocardio de la AI bastante sano, y luego ocurre en otras áreas de las paredes auriculares a medida que la enfermedad progresa hacia FA persistente 59.
El ensayo STAR AF II 66, un ensayo grande, multicéntrico y aleatorizado que realizó ablación con sustrato y desencadenante para la reducción de la FA, mostró que la ablación lineal empírica o la ablación por electrograma fraccionado complejo no tuvieron un beneficio en comparación con el aislamiento simple de la VP en pacientes con FA persistente 66. Estudios más recientes también mostraron la importancia de la zona de bajo voltaje en la ablación de FA. Mediante modificaciones adicionales de las zonas con electrogramas de bajo voltaje en la AI, la tasa de recurrencia de FA disminuyó solo mediante el aislamiento de la VP 67. Por lo tanto, conocer los sitios de aparición de zonas de baja tensión es hoy en día una preocupación creciente. Podría ser útil evaluar la apariencia del LGE específico del sitio antes de la ablación de la FA, en una modificación adicional en el sitio remodelado de la AI junto con el aislamiento de las VP. Los avances en las técnicas de resonancia magnética cardíaca permiten ahora la adquisición de imágenes LGE con suficiente resolución espacial para estudiar la pared auricular. Debido a que los agentes de contraste a base de gadolinio tienen una distribución intersticial, las áreas de LGE en la aurícula representan áreas donde la fibrosis intersticial es más pronunciada 68. En este contexto, Cochet H et al. 69 evaluaron la relación entre la fibrosis y la actividad de reentrada en 41 pacientes con FA persistente (edad 56±12 años). Realizaron imágenes electrocardiográficas (ECGI) de alta resolución durante la FA utilizando una matriz de electrodos de 252 tórax. Se aplicó un mapeo de fases para localizar la actividad reentrante. Los sitios de alta actividad reentrante se definieron como regiones reentrantes. Se realizó luego LGE-RMN con una resolución de 1,25 x 1,25 x 2,5 mm para caracterizar la fibrosis auricular y medir los volúmenes auriculares. Se analizó la relación entre la carga de LGE y el número de regiones reentrantes. La densidad local de LGE se calculó y caracterizó en los sitios reentrantes 69. Todos sus pacientes se sometieron a ablación con catéter dirigido a regiones de reentrada, siendo el criterio de valoración del procedimiento la terminación de la FA. Se analizaron los predictores clínicos, cardíacos LGE-RMN y ECGI del éxito del procedimiento agudo. Descubrieron que la carga de LGE en la AI era del 22,1±5,9% de la pared y el volumen de la aurícula izquierda era de 74±21 ml/m2. El número de regiones reentrantes fue de 4,3±1,7 por paciente. Las imágenes de LGE de la AI se asociaron significativamente con el número de regiones reentrantes (R=0,52; p=0,001), con el volumen de la AI (R=0,62; p<0,0001) y con la duración de la FA (R=0,54; p= 0,0007). El análisis regional demostró una agrupación de actividad reentrante en las fronteras de LGE. Las áreas con alta actividad reentrante mostraron una mayor densidad local de LGE en comparación con las áreas auriculares restantes (p<0,0001). Además, el hecho de no lograr la terminación de la FA durante la ablación con catéter se asocia con una mayor carga de LGE-RMN de la AI (p<0,001), un mayor número de regiones reentrantes (p<0,001) y una mayor duración de la FA (p=0,008). Por lo tanto, los autores concluyeron que el número de regiones reentrantes durante la FA se relaciona con la extensión del LGE en la RMN cardíaca, y la ubicación de estas regiones se agrupa en áreas del LGE. Estas características afectan los resultados del procedimiento de ablación 69. Estos hallazgos son consistentes con estudios previos 70 y respaldan el uso de LGE-RMN antes de la ablación de la FA para evaluar la fibrosis y la remodelación auricular. Aunque, Cochet H et al. 69 también cuantificaron LGE-RMN en la aurícula derecha, las relaciones con las características clínicas fueron más débiles que en la aurícula izquierda. Este hallazgo sugirió que la evaluación de la fibrosis por LGE-RMN es menos sólida en la aurícula derecha que en la aurícula izquierda. Sin embargo, esto también podría reflejar un mecanismo distinto de reentrada debido a diferencias anatómicas, estructurales o funcionales entre la aurícula izquierda y la derecha.
Jadidi AS et al. 71 demostraron una relación inversa entre la extensión de LGE-RMN y la duración del ciclo de FA medida en la orejuela de la AI en un estudio clínico en pacientes con FA persistente. Por tanto, un creciente conjunto de pruebas sugiere que la carga de fibrosis está relacionada con la complejidad global de los mecanismos de la FA. En un estudio reciente, Chrispin J et al. 72 informaron una falta de asociación regional entre el LGE auricular y los rotores identificados mediante la tecnología de mapeo de impulso focal y rotor en pacientes con FA persistente. Sin embargo, cada vez hay más pruebas que respaldan el papel de la fibrosis en el anclaje de la reentrada durante la FA. Estos hallazgos provienen de un estudio clínico anterior que informa sobre una agrupación de electrogramas auriculares fraccionados complejos alrededor de áreas fibróticas auriculares evaluadas con LGE-RMN 71.
El estudio DECAAF 36 mostró claramente una curva de aprendizaje significativa con el número de pacientes evaluados. Los avances en las técnicas de imagen y el hardware de los escáneres, así como una mejor capacitación de los tecnólogos de resonancia magnética, pueden mejorar aún más la calidad de la imagen de LGE-RMN de la AI. El estudio DECAAF II 73, investigó la eficacia y los eventos adversos de atacar la fibrosis auricular detectada en imágenes de RMN cardiaca para reducir la recurrencia de arritmia auricular en la FA persistente. Se comparó la eficacia de la ablación de la fibrosis guiada por resonancia magnética de realce tardío frente al catéter convencional en pacientes con FA persistente. Este ensayo clínico fue un estudio aleatorizado, multicéntrico, iniciado por un investigador que involucró 44 centros académicos y no académicos en 10 países. Un total de 843 pacientes con FA persistente sintomática o asintomática fueron sometidos a ablación de FA desde julio de 2016 a enero de 2020, con seguimiento hasta el 19 de febrero de 2021. Los pacientes con FA persistente fueron asignados aleatoriamente a aislamiento de venas pulmonares (PVI) más ablación de la fibrosis auricular guiada por resonancia magnética con realce tardío (421 pacientes) o PVI solo (422 pacientes). Se realizó una RMN cardiaca con realce tardío en ambos grupos antes del procedimiento de ablación para evaluar la fibrosis auricular inicial, y a los 3 meses después de la ablación para evaluar la cicatriz de ablación. El criterio de valoración principal fue el tiempo transcurrido hasta la primera recurrencia de la arritmia auricular después de un período de cegamiento de 90 días. El resultado primario compuesto de seguridad se definió por la aparición de 1 o más de los siguientes eventos dentro de los 30 días posteriores a la ablación: accidente cerebrovascular, estenosis de VP, hemorragia, insuficiencia cardíaca, o muerte 73. Entre los 843 pacientes que fueron aleatorizados (edad media 62,7 años; 178 (21,1%) mujeres), 815 (96,9%) completaron el período de blanqueo de 90 días y contribuyeron a los análisis de eficacia. No hubo diferencias significativas en la recurrencia de la arritmia auricular entre los dos grupos (pacientes tratados con ablación guiada por fibrosis más PVI, 175 (43,0 %) frente a pacientes tratados solo con PVI, 188 (46,1 %); índice de riesgo (HR), 0,95 (IC 95%, 0,77-1,17); P= 0,63). Los pacientes del grupo de ablación guiada por fibrosis más PVI experimentaron una mayor tasa de resultados de seguridad (9 (2,2%) frente a 0 en el grupo de PVI solo; P = 0,001). Seis pacientes (1,5%) en el grupo de ablación guiada por la fibrosis más PVI tuvo un accidente cerebrovascular isquémico en comparación con ninguno en el grupo de PVI solo. Se produjeron dos muertes en el grupo de ablación guiada por fibrosis más PVI, y la primera fue posiblemente relacionado con el procedimiento. Por lo tanto, los autores 73 concluyeron diciendo que entre los pacientes con FA persistente, la ablación de la fibrosis guiada por RMN cardiaca con realce tardío más PVI, en comparación con PVI sola no produjo diferencias significativas en la recurrencia de la arritmia auricular. Los hallazgos no respaldan el uso de la ablación de la fibrosis guiada por resonancia magnética para el tratamiento de la FA persistente 73. Además, en los casos de pacientes con procesos fibróticos extensos, no es aconsejable la ablación del sustrato anatómico. En los casos de pacientes con clases Utah III/IV con fibrosis difusa y extensa, se debe considerar un enfoque convencional no invasivo porque las probabilidades de ausencia de la fibrilación auricular a largo plazo son muy bajas después de la ablación con catéter de la fibrilación auricular (figura 4) (36, 73).
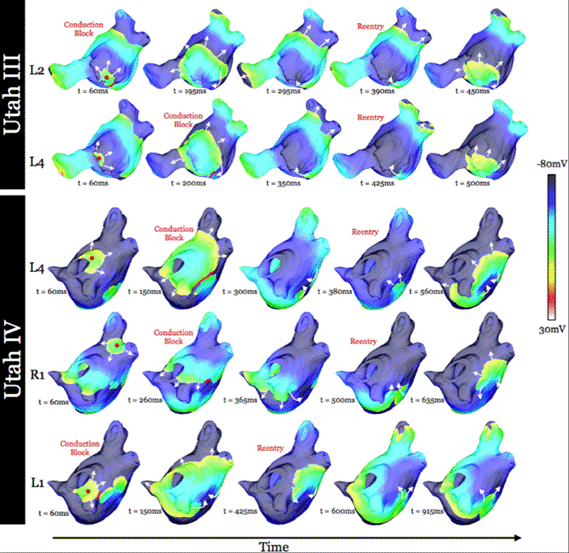
Figura 4 Mapas de potencial transmembrana epicárdico en dos instantes de tiempo en los modelos auriculares Utah III (fila superior) y Utah IV (fila inferior) que demuestran una ubicación instantánea de la singularidad de fase en el instante de tiempo del mapa de potencial transmembrana, así como el contorno del potencial transmembrana confinado. región de precesión de las singularidades de fase persistentes. Reimpreso con autorización de McDowell KS, Zahid S, Vadakkumpadan F, Blauer J, MacLeod RS, Trayanova NA. Virtual Electrophysiological Study of Atrial Fibrillation in Fibrotic Remodeling. PLoS ONE 2015;10(2): e0117110. doi:10.1371/journal.pone.0117110 (22).
Se necesitan estudios de investigación adicionales para analizar más a fondo cómo las reentradas se anclan a áreas específicas del sustrato auricular y, en particular, para discriminar entre mecanismos de reentrada estructurales y funcionales. La evaluación de los mecanismos de remodelación estructural y arritmia auricular durante la FA es factible combinando LGE-RMN con datos de ECGI, más análisis histológicos cuantitativos semiautomáticos que identifican fibrosis, cambios fibróticos en el tejido adiposo y miocardio auricular (figura 5). Este enfoque multimodal no invasivo puede ser valioso para personalizar modelos biofísicos, con importantes aplicaciones potenciales para diagnóstico, pronóstico y terapia.
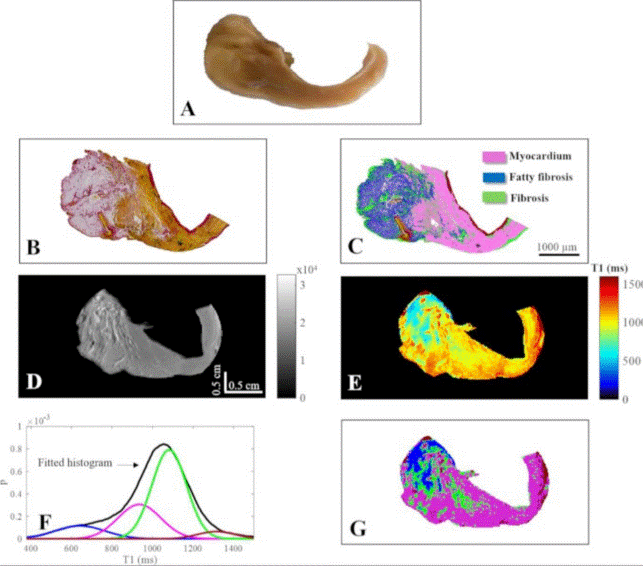
Figura 5 Muestra representativa de aurícula izquierda (histología y resonancia magnética). (A) Muestra representativa de la aurícula izquierda (macroscopia), (B) fotomicrografía de la sección teñida con Picro-Sirius que muestra tejido adiposo, remodelación fibrótica y miocardio y (C) análisis cuantitativo semiautomático que identifica fibrosis, cambios fibróticos en el tejido adiposo y miocitos. Aumento 10X, barra de escala 1000 μm. (D) Imagen de la misma muestra adquirida matriz = 192 x 96, (E) mapa T1, (F) histograma T1 con 4 distribuciones gaussianas y el mapa de agrupación correspondiente en (G). Reimpreso con autorización de Bouazizi K, Rahhal A, Kusmia S, Evin M, Defrance C, Cluzel P, et al. (2018) Differentiation and quantification of fibrosis, fat and fatty fibrosis in human left atrial myocardium using ex vivo MRI. PLoS ONE 2018;13(10): e0205104. https://doi.org/10.1371/journal.pone.0205104. (18).
CONCLUSIÓN
En conclusión, la fibrosis auricular debe considerarse como un potencial factor clave en el mecanismo de la arritmia y en el tratamiento de la FA. El desarrollo de la fibrosis auricular es un proceso multifactorial que resulta en complejas interacciones neurohumorales y celulares. La consideración de la fibrosis auricular para el tratamiento terapéutico de la FA tiene el potencial de mejorar significativamente la comprensión y los resultados clínicos de la FA. La LGE-RMN proporciona un excelente avance en el conocimiento del sustrato auricular. Es una potente herramienta de diagnóstico no invasiva que permite investigaciones de seguimiento sin exposición a la radiación ni riesgo de un procedimiento percutáneo invasivo. Aunque es difícil escanear a los pacientes durante la FA con LGE-RMN, es probable que los avances en las estrategias de adquisición de RMN cardiaca, como los cambios latido a latido en el tiempo de inversión y los esquemas inteligentes de rechazo de arritmias mejoren esta dificultad. Sin embargo, las técnicas LGE-RMN para evaluar la fibrosis de la AI todavía requieren una experiencia significativa; por lo tanto, es necesario establecer más mejoras técnicas y métodos de obtención de imágenes más generalizados.
Existe una amplia variación individual en la extensión de la fibrosis auricular izquierda en pacientes con FA. La fibrosis auricular es el predictor más importante de fracaso de la ablación más allá del aislamiento de las venas pulmonares. El mapeo de voltaje como herramienta para describir cambios fibróticos aún está bajo investigación. Depende de varias variables biológicas y tecnológicas y aún es necesario estandarizarlo. La ablación de la fibrosis del sustrato anatómico auricular es un enfoque eficaz de control del ritmo en pacientes con FA a pesar del aislamiento duradero de las venas pulmonares. No obstante, ha demostrado poseer más complicaciones que la estrategia convencional de ablación solamente de las venas pulmonares. La combinación de un modelo de geometría pulmonar y de la AI específico del paciente con una segmentación de cicatrices auriculares de procesamiento manual objetivo deben confirmarse y validarse con respecto a la eficacia y la seguridad individual en estudios clínicos internacionales, prospectivos, multicéntricos, aleatorizados con una numerosa población de pacientes con FA persistente.















