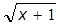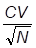INTRODUÇÃO
Luehea divaricata Mart. & Zucc. é uma espécie da família Malvaceae, conhecida popularmente como açoita-cavalo e identificada como espécie sucessional pioneira em algumas regiões do Rio Grande do Sul (Chami, Araújo, Longhi, Kielse y Lúcio, 2011). Essa espécie assumiu destacada importância ao longo da história e do desenvolvimento da indústria madeireira no sul do Brasil, uma vez que sua exploração extrativista descontrolada acarretou em uma drástica redução dos exemplares com boas características para o uso comercial, tornando necessária a pesquisa de sistemas eficientes de produção de mudas (Reitz, Klein e Reis, 1988).
A produção de mudas via seminal tem sido limitada pela reduzida disponibilidade de sementes de adequada qualidade física, fisiológica, genética e sanitária de açoita-cavalo. Adicionalmente, estudos envolvendo a recuperação de áreas de mata ciliar e mecanismos de regeneração natural em remanescentes de floresta, demostraram que a presença da espécie no banco de sementes do solo e no banco de plântulas não garante o estabelecimento de uma regeneração natural da espécie (Chami et al., 2011).
Nesse sentido, estudos relacionados à propagação vegetativa de açoita-cavalo (Nazário, Wendling e Souza, 2007; Flôres et al., 2011), usando diferentes técnicas de cultura de tecidos, como a micropropagação, apontaram que a espécie apresenta potencialidade de multiplicação por meio de métodos alternativos ao método convencional, via sementes. A multiplicação in vitro tem como finalidade a proliferação dos explantes oriundos da fase de estabelecimento (Dutra, Wendling & Brondani, 2009). Nesta fase, aos meios nutritivos utilizados rotineiramente, podem ser acrescentados reguladores de crescimento da classe das auxinas e/ou citocininas com a finalidade de estimular a propagação. As citocininas promovem a divisão celular e a superação da dominância apical, permitindo a proliferação de gemas axilares (Oliveira et al., 2007), sendo 6-Benzilaminopurina (BAP) uma das mais utilizadas, em concentrações que variam de 0,8 a 800µM.
Outras citocininas, além de BAP, também são utilizadas na multiplicação in vitro, tais como Cinetina (CIN), 2-Isopenteniladenina (2iP), as quais são consideradas, entretanto, menos eficientes que a primeira (Grattapaglia e Machado, 1998). Thidiazuron (TDZ), um composto sintético do grupo das feniluréias, que, inicialmente, foi classificado no grupo das auxinas, mas com uma posição ambígua, podendo também atuar como citocinina (Barrueto-Cid, 2010), vem sendo igualmente avaliado.
Considerado o exposto, o objetivo do presente estudo foi avaliar a resposta de culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc., isolados de plântulas obtidas via germinação in vitro, aos estímulos de diferentes fontes e concentrações de citocinina na multiplicação in vitro.
MATERIAL E MÉTODOS
Neste estudo, foram utilizados, como explantes, epicótilos contendo uma ou duas gemas axilares, com aproximadamente 10mm de comprimento, isolados de plântulas germinadas em condições assépticas com 45 dias de cultivo in vitro em meio nutritivo MS (Murashige & Skoog, 1962). O delineamento experimental utilizado foi o inteiramente casualizado, em arranjo bifatorial 4 x 4, em que os níveis do fator “A” referiram-se à fonte de citocinina e os níveis do fator “B”, às concentrações utilizadas. Os tratamentos consistiram de 0; 5; 10 ou 15μM das seguintes fontes de citocinina: 2-Isopenteniladenina (2iP), 6-Benzilaminopurina (BAP), Cinetina (CIN) e Thidiazuron (TDZ). A unidade experimental foi composta por um frasco de vidro com capacidade para 150 mL, contendo 30 mL de meio nutritivo e três explantes cada, sendo utilizadas oito repetições por tratamento.
O meio nutritivo empregado foi o MS, acrescido de 3% (p/v) de sacarose, 0,7% (p/v) de ágar e 0,01% (p/v) de mio-inositol, sendo o pH ajustado para 5,8. Posteriormente, os frascos foram vedados com papel alumínio e autoclavados à temperatura de 121 ºC e 1atm, por 15min. Após a inoculação dos explantes, os frascos foram dispostos em sala de cultivo sob fotoperiodo de 16h, intensidade luminosa de 20 µmol m-2 s-1, fornecida por lâmpadas fluorescentes brancas frias tipo luz do dia, e temperatura de 25±3 ºC. As avaliações foram realizadas após 45 dias de cultivo, sendo analisadas as variáveis: porcentagem de sobrevivência e de estabelecimento in vitro, número de gemas, número de ápices caulinares, número de folhas e porcentagem de formação de calos.
Na análise dos dados, foram, inicialmente, verificados os pressupostos do modelo matemático, e, quando necessário, os dados foram transformados pela função
. Na sequência, foram realizadas as análises de variância, e quando o valor de F foi significativo, utilizou-se a comparação das médias pelo teste de Skott-Knott ao nível de 5% de probabilidade de erro, para tratamentos qualitativos. Já para os tratamentos quantitativos, foi realizada análise de regressão polinomial ao nível de 5% de probabilidade de erro. Utilizou-se o programa estatístico Sisvar (Sistema para Análise de Variância) para Windows®, versão 5.1 (Ferreira, 2011). Para determinar a precisão dos ensaios foi estimado o Índice de Variação (IV), calculado por , em que o IV é igual ao coeficiente de variação (CV) dividido pela raiz quadrada do número de repetições (N) (Pimentel-Gomes, 2009).RESULTADOS E DISCUSSÃO
Em relação à sobrevivência in vitro dos explantes, não foram observados efeitos significativos dos fatores concentração de citocinina, fonte de citocinina e, tampouco, da interação entre ambos os fatores. Porém, foi observada uma média geral elevada, de 98,43% (IV= 2,59%) de sobrevivência, o que demonstra que a suplementação dessa classe de reguladores não é necessária para manter os explantes de açoita-cavalo vivos.
Para o estabelecimento in vitro houve efeito significativo dos fatores fonte de citocinina, concentração de citocinina e da interação entre os dois (IV= 5,14%). Na análise desta variável foi desdobrada a interação, verificando-se o fator quantitativo para cada nível do fator qualitativo. Equações polinomiais de segundo grau foram ajustadas para concentrações de CIN e TDZ, enquanto aquelas relacionadas a 2iP e BAP ajustaram-se a equações lineares (Figura 1).

Figura 1 Porcentagem média de estabelecimento in vitro de culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc (açoita-cavalo) cultivados em meio nutritivo MS acrescido de diferentes fontes e concentrações de citocininas, após 45 dias de cultivo in vitro. UFSM, Santa Maria, RS.
Na ausência de citocinina, independentemente da fonte, os explantes apresentaram resposta semelhante, alcançando mais de 95% de estabelecimento in vitro. No entanto, na presença de citocininas, o estabelecimento foi diferenciado; enquanto com TDZ os aumentos na concentração afetaram negativamente o estabelecimento in vitro dos explantes, cuja média diminuiu de 54% a 5µM para 29% na concentração 15µM deste fitorregulador, e, na presença das demais citocininas avaliadas (BAP, CIN e 2iP), as médias mantiveram-se entre 90 e 100%. Portanto, apesar de ter sido observado efeito significativo da interação entre os dois fatores avaliados, a retomada do crescimento de explantes juvenis, como os epicótilos, em açoita-cavalo, cultivados em meio nutritivo MS, assim como a sua sobrevivência, prescinde da presença de citocininas.
De maneira semelhante, em outro estudo com Luehea divaricata Mart. & Zucc. (açoita-cavalo), no qual foram empregados, como explantes, segmentos nodais cultivados em meio nutritivo WPM, tanto a sobrevivência quanto o estabelecimento in vitro não foram afetados de maneira significativa pelos tratamentos (concentrações mais elevadas de BAP, que variaram entre 0,0 e 66µM), sendo observada, uma média geral de 80,85% para ambas as variáveis (Flôres et al., 2011).
Para o número de gemas formadas houve efeito significativo dos fatores fonte de citocinina, concentração de citocinina e a interação entre ambos os fatores (IV= 15,91%). Equações polinomiais de segundo grau foram ajustadas para concentrações de BAP, CIN, TDZ, enquanto àquelas de 2iP ajustaram-se a uma equação linear (Figura 2).

Figura 2 Número médio de gemas formadas em culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc (açoita-cavalo) cultivados em meio nutritivo MS acrescido de diferentes fontes e concentrações de citocininas, após 45 dias de cultivo in vitro. UFSM, Santa Maria, RS.
Observou-se, que na presença de citocinina, especialmente nas concentrações mais baixas em relação a BAP e CIN, a formação de gemas nos explantes foi inferior àquela verificada nos respectivos tratamentos controle (sem citocinina). Por outro lado, com o aumento nas concentrações de 2iP e TDZ, a redução no número de gemas foi mais expressiva, principalmente com a última citocinina, que evidenciou melhor essa reação negativa das culturas. Na ausência de qualquer uma dessas citocininas, a formação de gemas variou entre 9 e 10,38 por frasco. No entanto, quando o cultivo foi realizado na presença de 5µM de 2iP ou TDZ, esses valores diminuíram entre 1,2 e 6,9 vezes respectivamente.
Deve-se destacar, contudo, em particular, o efeito detrimental de TDZ, cuja concentração a 15µM reduziu em 13,8 vezes àquela média alcançada no tratamento controle. Ainda, as concentrações de TDZ empregadas no presente ensaio, podem ser consideradas muito elevadas para os explantes inoculados no meio nutritivo, de maneira análoga ao que aconteceu quando concentrações de TDZ superior a ~2µM, reduziram a capacidade organogênica em gemas apicais de Ricinus communis L. (mamoneira) cultivado em meio MS (Ribeiro et al., 2010). Da mesma maneira, em outro estudo, segmentos nodais de açoita-cavalo cultivados em meio nutritivo WPM contendo BAP (0,0 - 66µM) desenvolveram menor número de nós - que correspondem ao local de inserção das gemas - na presença das concentrações mais elevadas da citocinina (Flôres et al., 2011).
Por outro lado, respostas diferentes foram observadas em segmentos caulinares de Rubus idaeus L. (amoreira-preta), cultivados por quatro semanas em meio nutritivo MS (Erig, De Rossi e Fortes, 2002), e segmentos caulinares de Eugenia uniflora L. (pitangueira), cultivados por 45 dias em meio WPM (Souza, Pastorini Donini, Wulf Schuch e Farias Ribeiro, 2008). Nesses casos, com a elevação das concentrações de BAP (0,0 a 10µM), em amoreira-preta, e das citocininas BAP, 2iP e Zeatina (ZEA) (0,0 a 10µM), em pitangueira, o número de gemas formadas em ambas as espécies sofreram acréscimos, assim como em Hancornia speciosa Gomes (mangabeira), quando ápices caulinares cultivados em meio WPM, acrescido de, aproximadamente, 8µM das citocininas BAP, CIN e TDZ, o número de gemas formadas, no cultivo em meio nutritivo suplementado com BAP, foi superior em comparação àquele observado na presença das demais citocininas (Soares et al., 2011).
As respostas observadas no presente ensaio demostraram que o efeito das citocininas sobre a proliferação de explantes cultivados in vitro não é controlado somente pelo tipo de regulador de crescimento e por suas concentrações. Também é necessário admitir a dependência de outros elementos que podem estar ligados a fatores tais como: espécie de planta e sua estrutura genética, tipo de explante e composição base do meio nutritivo, entre outros.
Para o número de ápices caulinares formados houve efeito significativo dos fatores fonte de citocinina, concentração de citocinina e da interação entre ambos (IV= 8,71). Neste caso, as equações ajustadas foram de segundo grau para as concentrações de TDZ e 2iP, e de terceiro grau, para as concentrações de BAP. Já, as concentrações de CIN, não se ajustaram a nenhum modelo testado, apresentando a mesma média em todas as concentrações utilizadas (Figura 3).
Ápices caulinares foram formados em menor número na presença de citocininas no meio nutritivo, exceto no caso de BAP, em que na concentração 10µM formou-se a mesma quantidade de ápices que no tratamento controle (três ápices). Por outro lado, utilizando-se 5 ou 15µM, o número médio de ápices caulinares foi menor (2,37 e 2,75 respectivamente). Ao contrário, com o emprego da citocinina 2iP, formou-se o menor número de ápices caulinares (2,5) na concentração 10µM, enquanto nas concentrações 5 e 15 µM, desenvolveram-se 2,62 ápices caulinares respectivamente. Apesar disso, essas médias são também inferiores àquelas formadas na ausência de 2iP. Por outro lado, a citocinina TDZ registrou decréscimos na formação de ápices caulinares a partir do aumento nas concentrações no meio nutritivo, em que também originaram-se três ápices na ausência de TDZ, reduzindo-se com sua presença (1,4 a 5µM e 0,75 a 10 ou 15µM) (Figura 3).
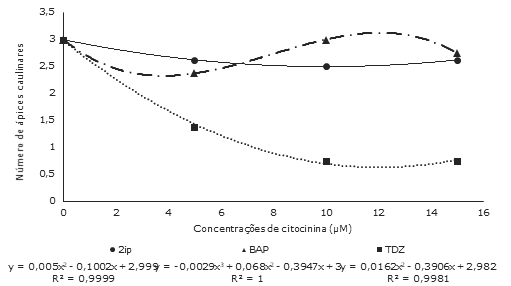
Figura 3 Número médio de ápices caulinares formados em culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc (açoita-cavalo) cultivados em meio nutritivo MS acrescido de diferentes fontes e concentrações de citocininas, após 45 dias de cultivo in vitro. UFSM, Santa Maria, RS.
Em estudo utilizando segmentos nodais de Gmelina arborea Roxb. cultivados por 30 dias em meio nutritivo MS acrescido de concentrações entre 0,5 a 10µM de BAP, observou-se que o desenvolvimento de brotos variou, em média, entre 2,5 e 2,2 por explante, nas concentrações 1µM e 4µM da citocinina, respectivamente, registrando leves diminuições a partir do aumento na concentração desse fitorregulador (Sukartiningsih & Ide, 1999). Efeito contrário para o número de brotações foi obtido em segmentos caulinares de Eugenia uniflora L. (pitangueira) cultivados por 45 dias em meio WPM, demostrando uma relação diretamente proporcional ao aumento das concentrações, 0 a 10µM, das citocininas BAP, 2iP e ZEA (Souza et al., 2008).
No presente ensaio observou-se que, embora o número de ápices tenha aumentado nas concentrações mais altas de 2iP e BAP, não se justifica a utilização dessas citocininas no meio nutritivo, visto que, na sua ausência, a formação de ápices caulinares ocorre igualmente, inclusive superando os valores obtidos com as concentrações testadas. Inclusive, pode-se dizer, com isso, que as concentrações de citocinina atuaram como agentes inibitórios dessa variável.
Para o número de folhas formadas ocorreu efeito significativo dos fatores fonte de citocinina, concentração de citocinina e da interação entre ambos os fatores (IV= 13,87%). As concentrações de BAP, CIN e TDZ foram ajustadas por equações polinomiais de segundo grau, enquanto para as concentrações de 2iP ajustou-se uma equação linear (Figura 4).
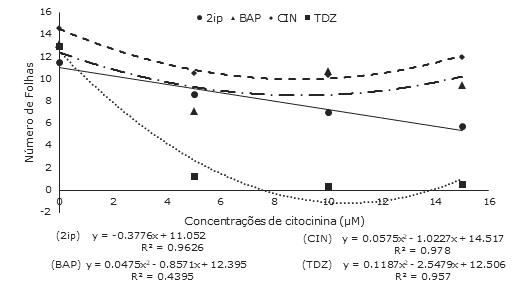
Figura 4 Número médio de folhas formadas em culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc (açoita-cavalo) cultivados em meio nutritivo MS acrescido de diferentes fontes e concentrações de citocininas, após 45 dias de cultivo in vitro. UFSM, Santa Maria, RS.
Assim, para o número de folhas formadas puderam ser observadas diferenças inclusive entre os tratamentos controle, refletidas por médias distintas, de acordo com cada fonte de citocinina testada. Apesar disto, este desempenho não pode ser atribuído ao efeito dos tratamentos, visto que, nesses não foram adicionados fitorreguladores, o que sugere que os resultados sejam decorrentes de fatores intrínsecos do próprio explante. No entanto, ao utilizar-se citocinina no meio nutritivo, tanto BAP, como CIN, em concentrações superiores a valores calculados pela MET (9µM e 8,9µM respectivamente), o número de folhas registrou aumentos, embora, não superando aqueles obtidos na ausência desses fitorreguladores.
Enquanto isso, as demais citocininas utilizadas (2iP e TDZ), não favoreceram a formação de folhas, que foi mais intensamente prejudicada pelos aumentos nas concentrações de TDZ. Os valores obtidos com a sua utilização foram visivelmente inferiores aos alcançados com o aumento de 2iP no meio nutritivo, sendo que essa diferença entre ambas as citocininas, para as mesmas concentrações, variou de 6,9 até 18 vezes nos tratamentos com TDZ comparados aos tratamentos utilizando 2iP. Resultados semelhantes foram encontrados em Hancornia speciosa Gomes (mangabeira), quando ápices caulinares cultivados em meio WPM acrescido de, aproximadamente, 8µM das citocininas BAP, CIN e TDZ, os dois primeiros promoveram maior formação de folhas que TDZ (Soares, Paiva, Alvarenga, Very, Vargas e Silva, 2011).
A formação de calos foi influenciada significativamente apenas pela concentração de citocinina, mas não foi afetada pela fonte do fitorregulador, nem, tampouco, pela interação entre ambos os fatores (IV= 19,33%). Nesse caso, a equação ajustada para concentrações de citocinina foi uma polinomial de segundo grau (Figura 5).
A formação de calos variou entre 13 e 62% para as diferentes concentrações de citocininas utilizadas no presente experimento. As concentrações intermediárias (5 e 10µM) foram as que favoreceram a maior formação destas estruturas, sendo que 11,3µM seria a concentração com a qual seriam observadas mais formações de calo, de acordo com o cálculo da MET.
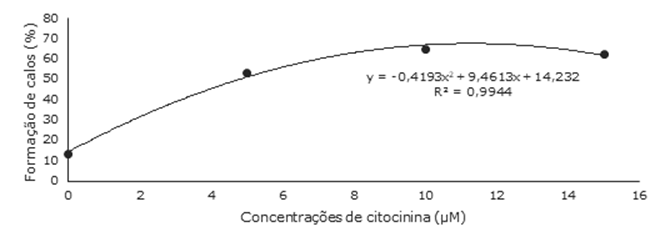
Figura 5 Porcentagem média de calos formados em culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc (açoita-cavalo) cultivados em meio nutritivo MS, acrescido de diferentes concentrações de citocinina, independentemente da fonte (BAP, CIN, 2iP e TDZ), após 45 dias de cultivo in vitro. UFSM, Santa Maria, RS.
Brotos de Gmelina arborea Roxb., cultivados por 30 dias em meio nutritivo MS, acrescidos de concentrações entre 0,5 a 8µM de BAP, desenvolveram elevada formação de calos compactos em detrimento da formação de brotos. Isto foi intensificado quando os explantes foram submetidos a meios nutritivos com idênticas concentrações de BAP em combinação a TDZ (0,5 a 10µM) (Sukartiningsih et al., 1999).
A formação de calos nos explantes não pode ser atribuída especificamente a uma citocinina, uma vez que, não foram evidenciadas diferenças para esse fator. No entanto, é sabido que o TDZ também pode agir como uma auxina, apresentando maior atividade biológica, em comparação às outras fontes de citocinina avaliadas no presente ensaio. Isto possivelmente se deva ao incremento da atividade da enzima fosfatase ácida, responsável pela interconversão nucleotídeo-nucleosídeo da estrutura de citocininas endógenas, tornando-as biologicamente ativas, ainda que esta citocinina possa atuar como inibidor do crescimento, se utilizada em elevadas concentrações (Barrueto-Cid, 2005; Ribeiro et al., 2010).
Contudo, analisando as respostas das diferentes variáveis-resposta em relação às diferentes fontes e concentrações de citocinina, pode-se inferir que a baixa reatividade dos explantes aos estímulos do TDZ, deva-se a maior eficiência que os tecidos vegetais possuem em sintetizar os hormônios naturais, em comparação aos reguladores de crescimento sintéticos (Grattapaglia e Machado, 1998), considerando que as demais citocininas (BAP, 2iP e CIN), também se encontram em forma natural nos tecidos.
Também se deve levar em conta o próprio metabolismo das citocininas, uma vez que muitos tecidos possuem, naturalmente, a enzima citocinina oxidase, a qual pode desativar, irreversivelmente, as citocininas. Provavelmente disto decorram influências na regulação ou na limitação dos efeitos desses fitorreguladores, sendo a atividade da referida enzima induzida por concentrações altas de citocinina (Taiz & Zeiger, 2009).
CONCLUSÕES
Na multiplicação in vitro de culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc., é dispensável o uso das citocininas 6-Benzilaminopurina (BAP), 2-Isopenteniladenina (2iP), Cinetina (CIN) e Thidiazuron (TDZ).
Na ausência das citocininas no meio nutritivo MS, culturas iniciadas a partir de epicótilos de Luehea divaricata Mart. & Zucc. apresentam melhores respostas em relação às variáveis sobrevivência e estabelecimento in vitro, número de gemas e número de folhas formadas.