Introducción
Una planta puede denominarse medicinal cuando al menos una parte de esta posee propiedades curativas. Puede estar contenida en la Farmacopea, pero ésta puede también contener plantas que no siendo medicinales son útiles en farmacia. Una planta no inscrita en la Farmacopea puede constituir un medicamento, incluso aunque no se la considere como planta medicinal (Bruneton, 2001).
Básicamente, el estudio de las plantas medicinales es desarrollado a través de la Fitoquímica que es considerada como una herramienta en el descubrimiento de moléculas a partir de ellas, además de establecer una relación entre la presencia de metabolitos secundarios y su actividad biológica (Heinrich et al., 2006).
El uso de plantas medicinales y aromáticas es una costumbre atávica y tiene su origen en el nacimiento del hombre; está basada en la experiencia que forma parte de la tradición de los pueblos, son conocimientos ancestrales que se transmiten de generación en generación y, particularmente en forma verbal (Heinrich et al., 2006).
La familia Anacardiaceae es un grupo de plantas esencialmente arbóreas y arbustivas perteneciente al orden Sapindales. La constituyen 77 géneros con unas 700 especies aceptadas, de las casi 3000 descritas, propias de países tropicales, cálidos y templados (Tropicos, 2018) (Fig. 1), y con cerca de 30 especies nativas en su mayoría se encuentran en América Central y del Sur (Perrotta & Arambarri, 2004).
Uno de los géneros más estudiados en America del Sur y Centro es el Schinus. Dentro de este género podemos mencionar especies ampliamente estudiadas como el Schinus molle, Schinus terebethifolius, Schinus Lentifolius. Una de las especies con escasos estudios pero prometedores por su información etnobotánica e la del Schinus weinmanniifolia.
Varios estudios han encontrado que las especies vegetales mayormente investigadas de la familia de las Anacardiaceae son: S. terebinthifolius, S. molle, y S. weinmannifolius y los cuales son comunes en América del Sur y tienen diversas actividades biológicas como antiviral en el extracto crudo hidroalcohólico y acuoso contra Herpes simplex virus type I en líneas celulares Vero (Jarbas et al., 2004), cicatrizante vía tópica en ratones Wistar (Branco Neto et al., 2006), antiulceroso (Bacchi, 1986) además de otras actividades.
El aceite esencial del Schinus molle se mostró que a que en bajas concentraciones presentaban un efecto adverso en ensayos in vivo (Ferrero et al., además de ser antitumoral en otros estudios a concentraciones específicas (Díaz & Quesada, 2008).
En el extracto crudo de hojas del Schinus terebinthifolius se encontraron efectos positivos como cicatrizante interno en la úlcera estomacal (Carlini et al 2010), cicatrizante externo en pruebas hechas con ratones (Branco Neto et al., 2006) y el aceite esencial posee una actividad antidepresiva (Piccinelli et al., 2014).
Durante varias investigaciones Fitoquímica de este género se han reconocido diferentes metabolitos secundarios como sesquiterpenos, triterpenos (Gehrke et al., 2013), flavonoides, taninos, saponinas esteroidales, esteroles y en algunos aceites esenciales (Díaz & Quesada, 2008; Erazo et al., 2004). Los estudios hechos con Schinus lentiscifolius aún son escasos salvo actividad antimicrobiana los cuales arrojaron resultados muy prometedores (Gehrke et al., 2013) y antiviral contra herpes tipo1 (Jarbas et al., 2004).
Este trabajo está orientado a determinar los posibles grupos de compuestos presentes y establecer atraves de bioensayos su actividad al extracto crudo estanólico proveniente de las hojas del Schinus weinmanifolius.
Materiales y Métodos
Muestreo
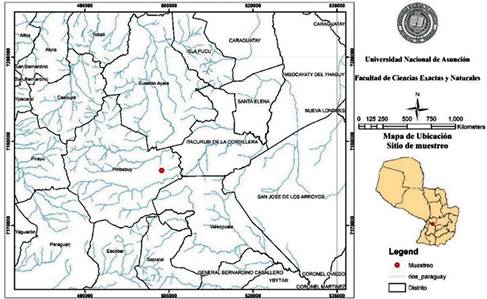
Las hojas de la especie estudiada fueron colectadas en Piraretá (Fig. 2), distrito de Piribebuy del Departamento de Cordillera coordenadas geográficas -25.499000, 56.963194. (Fig. 2). Partes representativas de la planta se emplearon en la identificación taxonómica en el Laboratorio de Análisis de Recursos Vegetales-Herbario FACEN por un experto del laboratorio y una muestra colectada fue depositada en el Herbario LAREV-FACEN bajo la identificación FACEN N° 4050.
Preparación del Material Vegetal para Extracción
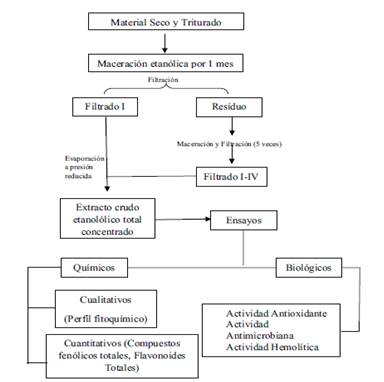
Una cantidad de 10 Kg de material vegetal fresco (Fig. 3) fue secado a temperatura ambiente (20°C) bajo sombra sobre pallets de madera por aproximadamente 1 semana, con escasa aireación, para evitar la acción del oxígeno, la luz, la temperatura y microorganismos; factores que podrían transformar los compuestos originales en compuestos biotransformados. Luego, se procedió a la trituración del material vegetal con la ayuda de un molino manual a tornillo hasta la obtención de un polvo homogéneo.
Elaboración de extracto crudo
Se realizó la maceración exhaustiva de 5 Kg de material triturado homogéneo con Etanol 96 % durante un mes, bajo agitación de 3 veces por semana. Transcurrido el tiempo, se procedió a la filtración de la fracción líquida por gravedad a través de un embudo de vástago provisto de gasa estéril. El residuo sólido se sometió al mismo proceso tres veces, con tiempos de maceración de 1 semana y hasta que no presente coloración los líquidos de lavado (aproximadamente un mes). Los extractos fueron unificados y posteriormente fueron evaporados con Rotavapor y el extracto crudo así obtenido (SC) se transfirieron a un frasco de vidrio ámbar y se mantuvo en refrigeración a 4 ± 0.5 °C. Se determinó el rendimiento de extracción del proceso de maceración. De la misma se realizaron todas las pruebas propuestas (Fig. 4).
Pruebas cualitativas-Perfil fitoquímico.
Detección de fitoesteroles
Las pruebas fueron realizadas según lo descrito por Tiwari et al., 2011 con algunas modificaciones. Para la prueba cualitativa de compuestos esteroidales por Reacción de Salkoswki, una porción de extracto, aproximadamente 100 mg, se trató con 2 mL cloroformo en un tubo de ensayos y se filtró. Al filtrado se agregaron gotas de. Ácido sulfúrico concentrado, se agitó y se dejó reposar.
Para el ensayo de Libermann-Burchard, aproximadamente 100 mg de extracto se trataron con 2 mL cloroformo y se filtró. Al filtrado fueron adicionadas unas gotas de anhídrido acético en un tubo de ensayo. Se llevó a ebullición por 3 minutos y fueron agregadas gotas de Ácido Sulfúrico concentrado por las paredes del recipiente que contiene la reacción.
En ambos casos, se observaron su comportamiento en cuanto a la coloración y se registraron los resultados. A fin de establecer una correcta observación, fueron realizados en paralelo ensayos de control positivo (100 mg de Colesterol) y negativo (Cloroformo p.a.) para ambas pruebas, tratando de la misma manera que las muestras (Tiwari et al., 2011).
Pruebas de detección de saponinas. Ensayo de espuma/afrosimétrica
Se siguió la metodología descrita por Valencia et al., (2005), donde se pesó aproximadamente 1.25 g de extracto (SC) en un tubo y se añadió 5 ml de agua destilada, se calentó en baño de agua hirviente por 2 minutos, se agitó vigorosamente, observándose la aparición de espuma muy persistente; la persistencia en minutos de la espuma se califica de la siguiente manera: 5 - 20 min. (+); 20 - 25 min. (++); 30 - Más (+++). Como control positivo se utilizó Saponina pura y como control negativo agua destilada. Ambos controles fueron sometidos al mismo tratamiento que la muestra.
Identificación de flavonoides.
Para el Ensayo de AlCl 3 una solución metanólica del extracto (SC) de 20 mg.mL-1 fue tratado con gotas del reactivo AlCl3 de 100 mg.mL de concentración en metanol.(Ahmed et al., 2015). Se utilizaron como controles solución de Rutina GR como control positivo y metanol como control negativos. 2 mL, registrándose el desarrollo de color si lo hubiere (Ahmed et al., 2015).
Para la Prueba Shinoda, 1 g del extracto SC fue tratado con 10 mL de agua destilada. La solución fue filtrada y 1 mL de la misma fue tratada con 50 mg de Magnesio en un tubo de ensayo a las que luego se adicionó gotas de HCl concentrado a la solución. (Hossain et al, 2013). Como control positivo fue utilizado 50 mg de Rutina GR y un blanco de reactivo como control negativo. Ambos fueron tratados de la misma manera que el tubo de ensayo (Hossain et al., 2013).
En el Ensayo de Rosenheim se llevó a cabo el ensayo según lo mencionado por Bonilla et al (2015) con algunas modificaciones. Se tomó una alícuota de 1 ml del extracto crudo acuoso al 2% y se le adicionó 0.5 mL de HCl(c) y se calentó durante 10 min en baño maría; se enfrió y adicionó 0.4 mL de alcohol amílico y se agitó; se dejó en reposo separándose las fases, y se observó la coloración de la fase amílica (Bonilla et al., 2015).
Pruebas de detección de cumarinas
La reacción de Baljet fue realizada lo descrito por Bell & Krantz, (1949) con algunas modificaciones. Una muestra de extracto crudo con aproximada- mente 0,1 g fue disuelta en 5 ml de Metanol. 1 mL de esta solución fue tratado en un tubo con 4 gotas de reactivo Baljet. Como control positivo se empleó una solución metanólica de Cumatetralil de 1 mg.mL-1 de concentración que fue tratada de la misma manera que la muestra. Se utilizó 1 mL de Metanol como control negativo (Bell & Krantz, 1949).
Para la Fluorescencia se desarrolló de acuerdo a lo descrito por Kuete. Una porción de aproximadamente 0,2 g de extracto (SC) se adicionó 25 mL de Metanol en un vaso de precipitados, el cual fue calentado a ebullición durante 10 minutos. Durante la misma, el vaso fue tapado con un papel de filtro impregnado con solución de NaOH 5 % (p/v) en etanol. Una vez terminado el tiempo de ebullición el papel de filtro fue expuesto en luz UV para verificar la aparición de fluorescencia a una longitud de onda de 254 nm y 365 nm. (Bruneton, 2001)
Identificación de taninos
Se desarrolló la identificación de Taninos por la reacción de Gelatina/Sal, de acuerdo a lo descrito en Kasay et al (2013) con algunas modificaciones. Para el ensayo se tomó una alícuota de 0,2 g de extracto (SC) en 5 mL de agua destilada, al que se adicionó 2 mL de reactivo Gelatina Sal. Fueron ensayados también 2 ml de la solución de Acido Tánico 5 mg.mL-1 en agua como control positivo y 2 mL de agua destilada como control negativo (Kasay et al., 2013).
Para el ensayo de FeCl 3 se tomó una alícuota de 0,2 g de extracto (SC) en 5 mL de agua y se adicionó gotas de FeCl3. Fueron ensayados también solución de Acido Tánico 5 mg.mL-1 como control positivo y 2 mL de agua destilada como control negativo. Ambos controles fueron tratados de la misma manera que el tubo de muestra.
En ambos casos, se registraron los resultados obtenidos (precipitado, formación de colores) (Kasay et al., 2013).
Identificación de quinonas
Para la Reacción de Borntrager modificado, fue realizado el ensayo según lo descrito por Martínez, (2012) con algunas modificaciones. Se pesó aproximadamente 20 mg de extracto y se disolvió con 5 mL de Benceno. Se agregó posteriormente 5 mL de NH4OH al 25 % v/v. Como control positivo se utilizó 5 mg de Fitomenadioma a la que se trató de la misma manera que la muestra y un blanco de reactivo como control negativo (Martínez, 2012).
Identificación de alcaloides.
Se llevó a cabo según lo descrito por Tiwari et al., 2011 con algunas modificaciones. La muestra SC se pesó aproximadamente 0,2 g y se suspendió en 10 mL de HCl 1 %(v/v). Se filtró y se dividió en cuatro fracciones para la realización de identificación de alcaloides por Wagner, Mayer, Reineckato de Amonio y Draggendorff. A cada fracción se adicionaron los reactivos anteriormente mencionados y se reg istraron los resultados (formación de precipitados) Como control negativo de cada uno de los ensayos se empleó el mismo HCl 1%(v/v) del tratamiento del extracto y como control positivo se empleó 10 mg de Morfina disueltos en 10 mL de HCl 1%(v/v), el cual se fraccionó en partes iguales y se adicionaron cada uno de los reactivos.
Reacciones cuantitativas
Compuestos fenólicos totales
El contenido de fenoles totales se determinó por el método colorimétrico de Singleton & Rossi, (1985) Taizalgunas adaptaciones. Se preparó solución metanólica del extracto crudo de aproximadamente 1 mg.mL-1.En matraz aforado de 10 mL se tomó una alícuota de la solución de extracto preparado, se adicionaron 2000 µL de agua y 200 µL del reactivo Folin-Ciocalteu 2N (grado analítico, Merck). Se agitó y luego se dejó en reposo por 5 minutos. Posteriormente se adicionaron 1500 µL de una solución acuosa Na2CO3 al 20%, se aforó a 10 mL con agua. Se agitó y se dejó en reposo por 1 hora en la oscuridad. Una vez transcurrido el tiempo, se leyó la absorbancia a 760 nm en un espectrofotómetro UV Visible.
Se empleó como blanco 1000 µL de Metanol en paralelo a fin de corregir cualquier interferencia provocada por la adición del mismo. Para la cuantificación, se compararon con soluciones patrones de Ácido Gálico, el cual se preparó primeramente una solución Stock de ácido gálico en metanol de 100 µg.mL-1. A partir de esta solución se prepararon en un rango comprendido entre 0,1 a 2 µg.mL-1 en diferentes matraces y se procedieron de la misma manera que en las muestras, con un volumen final de 10 mL. De los resultados se trazó una curva de calibrado para determinar la concentración equivalente de Acido Gálico.
Los resultados se expresaron como como mg equivalentes de ácido gálico (GAE).g-1; los valores se presentan como la media de los análisis realizados por triplicado ± desviación estándar (SD) (Singleton & Rossi, 1985)
Flavonoides totales
Para la realización del ensayo de flavonoides totales se ha ensayado según lo descrito por Kumazawa et al (2004) con mínimas modificaciones. Se prepararon soluciones metanólicas del extracto crudo de 25 mg de SC en matraz aforado de 25 mL empleando como solvente metanol. En sendos tubos de ensayos de reacción se adicionaron 2 ml de solución de muestra y 2 ml de solución de Reactivo (solución de AlCl3 al 2 % en metanol). Se homogeneizó cuidadosamente el contenido de cada tubo. La absorbancia de los productos de reacción fueron medidos a 367.5 nm en un espectrofotómetro. A fin de corregir el efecto matriz debido a la coloración de las muestras, se tomaron 2 mL de cada uno de las diluciones finales y se adicionaron 2 mL de Metanol, los que fueron medidos a la misma longitud de onda de trabajo.
Para los patrones de comparación, se empleó como patrón de Trabajo una solución stock de Quercetina de 1000 µg.mL-1 disueltos en Metanol. A partir de esta fueron preparados en matraces soluciones que van desde 0 a 50 µg mL-1 en intervalos de 10 µg mL-1. Se trataron 2 mL del contenido de cada matraz de la misma manera que las soluciones de muestra. A partir de los resultados, se preparó la curva de calibración. De la curva fueron determina- das las concentraciones equivalentes de Quercetina en cada tubo de muestra.
Los resultados se expresaron como como mg equivalentes de Quercetina.g-1 de extracto; los valores se presentan como la media de los análisis realizados por triplicado ± desviación estándar (SD) (Kumazawa et al., 2004)
Actividades biológicas
Actividad antioxidante
Se llevó a cabo la determinación de actividad antioxidante mediante el método descrito por Brand-Williams et al. (1995) que se basa en la medida de la absorbancia del Radical DPPH• con algunas modificaciones. (Brand-Williams et al., 1995).Se preparó la solución del Extracto crudo de 2 g.100 mL-1 en metanol. A partir de esta se realizó la dilución hasta obtener la concentración de 5µg.mL-1.
Para la reacción se tomó una alícuota de 100 µL de la solución muestra y 3,9 mL de solución de DPPH• en metanol de concentración 0.02 mg mL-1. Se homogenizó cuidadosamente y se mantuvo en oscuridad durante 1 hora. Posteriormente las lecturas de absorbancia se realizan a 517 nm en un espectrofotómetro. Se realizó una curva de calibración comprendidad entre 0 a 100 µg.mL-1de Ácido Ascórbico. Se tomaron 100 µL de estas soluciones y se tratan con los reactivos de la misma manera que las muestra. Los resultados se expresaron como como mg de Ácido Ascórbico.g-1 de Extracto Bruto; los valores se presentan como la media de los análisis realizados por triplicado ± desviación estándar (SD).
Actividad hemolítica
Éste ensayo fue llevado a cabo se acuerdo a lo establecido en Martínez et al., 2013.Se utilizó sangre humana donado por un voluntario. Toda la sangre extraída fue colocada en un tubo con Heparina sódica. Antes de iniciar el ensayo, la primera etapa es la preparación de las muestras de sangre. La sangre total heparinizada se centrifugó a 3.000 rpm durante 10 min y el precipitado celular fue sometido a tres lavados consecutivos con tampón PBS pH 7,4 para obtener los glóbulos rojos. Luego, se retiró la sobrenadante con cuidado y la solución sanguínea (aproximadamente 2 mL) se resuspendió nuevamente a 100 mL (solución al 2%) con tampón PBS para su uso en el ensayo.
Para la determinación espectrofotométrica de la Actividad hemolítica del extracto crudo, se pesó 50 mg del extracto crudo etanólico en un matraz volumétrico de 50 mL, se agregó 5 mL de etanol absoluto, se sonicó por 30 minutos y se llevó a volumen con tampón PBS pH 7,4, siendo ésta de una concentración de 1000 µg.mL-1 de extracto crudo. Se etiquetaron tres tubos de ensayo de la siguiente manera: Control negativo (CN), Control positivo (CP) y Solución Muestra(SM)
Seguidamente, se tomaron 2 mL de cada una de las soluciones y finalmente se adicionaron a todos los tubos 2,0 mL de suspensión de sangre al 2%. Se homogeneizaron y se dejaron en reposo por 30 minutos. Cumplido el periodo de reposo, se centrifugaron a 3000 rpm por 10 minutos y se procedió a la medición espectrofotométrica de absorbancia de la solución sobrenadante de cada uno de los tubos a una longitud de onda de 545 nm. La actividad hemolítica fue reportada como por ciento de Hemólisis (% Hem.)
Actividad antimicrobiana. Ensayo de difusión en disco
Se procedió a la Preparación de la Solución del extracto crudo en donde se prepararon soluciones de tres concentraciones distintas utilizando Dimetilsulfoxido (DMSO) como disolvente: C 1:30 mg.mL-1, C :25 mg.mL-1, C: 20 mg.mL-1.
Luego, se procedió a la Preparación de los Inóculos de microorganismos. Se utilizaron las siguientes bacterias Gram negativas: Escherichia coli (ATCC 8739), Salmonella typhimurium (ATCC 14028), Enterococcus faecalis (ATCC 29212) y Pseudomonas aeruginosa (ATCC 27853), las bacterias Gram positivas: Staphylococcus epidermidis (ATTC 12228) Staphylococcus aureus (ATCC 29737), Hongo: Candida albicans (ATTC 10231)
Utilizando técnicas asépticas se prepararon las suspensiones bacterianas y fúngicas. Para ello se tomaron colonias aisladas de las cepas menciona das y se suspendieron en solución salina 0,9 %; la turbidez de las mismas fue ajustada a la escala 0,5 Mc Farland correspondiente a 1,5.108 UFC.mL-1. Los inóculos fueron preparados en el día del ensayo. Por último, se inyectó la solución de los extractos en diferentes discos. Fueron preparados discos de papel de filtro cualitativo (Whatman grado 1) de 5 mm de diámetro, los cuales fueron esterilizados en autoclave por 15 minutos a 121 oC. En cada disco fueron impregnados 10µL de la solución del extracto.
También fueron preparados discos con las soluciones de control positivo de Anfotericina B (1 mg.mL-1) para Candida albicans; Meropenen (1 mg.mL-1) para Salmonella tiphimurium, Pseudomona aeruginosa y Escherichia coli; Vancomicina (5 mg.mL-1) para Staphylococcus aureus y Staphy- lococcus epidermidis; Ciprofloxacina (5 mg.mL-1) para Enterococcus faecalis y Dimetilsulfóxido (DMSO) como control negativo.
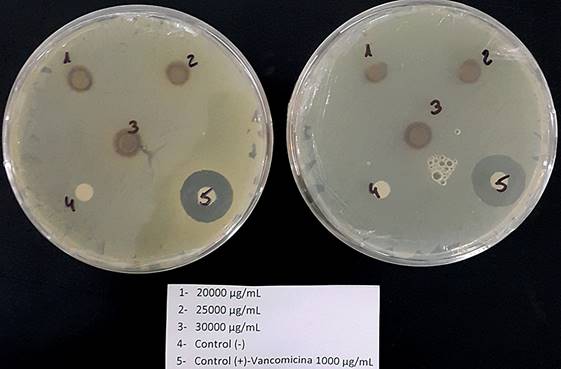
Para el ensayo propiamente dicho, en cada placa se distribuyen: tres discos con las tres concentracio nes mencionadas del extracto, un disco de control positivo y otro disco de control negativo en una distancia no menor de 24 mm entre los discos y a 15 mm de los bordes de las placas (Fig. 5) (Gamazo et al., 2009).
Las placas se incubaron aeróbicamente a 37°C durante 24-48 horas. La actividad antibacteriana fue determinada como la media del diámetro de inhibición producido alrededor de cada disco. Todos los ensayos fueron realizados por duplicado (Gyawali & Ibrahim, 2014).
Resultados y discusion
De acuerdo a los estudios realizados, el nombre de Schinus weinmanniifolia Mart. ex Engl., comparado con The Plant List (2013), posee una sinonimia no oficial: Schinus lentiscifolius Marchand.
Extracto bruto
Se obtuvieron 316 g de extracto bruto a partir de 5 Kg de hojas (previamente secas y trituradas) equivalente a un 6,32% de rendimiento.
Análisis Químico
Pruebas cualitativas-Perfil fitoquímico.
Considerando los resultados de las pruebas cualitativas del Perfil Fitoquímico (Tabla 1), en la reacción de Liebermann-Buchard y Salkowski revelaron la presencia de compuestos esteroidales en el extracto crudo etanólico de Schinus weinmannifolia. Estos resultados concuerdan con las otra especie del mismo género, en hojas del Schinus terebintifolius (Costa et al., 2015) y en donde han sido analizados extractos etanólicos de dicha planta, así como en extracto metanólico de las hojas del Schinus lentiscifolius (Aroeira) (Gehrke, 2012). Esto también se debió a la presencia de Saponinas (esteroidales) a través de la prueba de la espuma.
Tabla 1 Resumen de Ensayos Cualitativos.
| Ensayo | Metabolito Secundario | Resultado |
|---|---|---|
| Libermann-Buchard | Fitoesteroles | ++ |
| Salkowski | ++ | |
| Prueba de la Espuma | Saponinas | +++ |
| Prueba Afrosimétrica | +++ | |
| AlCl3 | ++ | |
| Shinoda | Flavonoides | + |
| Rosenheim | - | |
| Baljet | Cumarinas | - |
| Fluorescenia | - | |
| Precipitación de la Gelatina | Taninos | +++ |
| FeCl3 | +++(Azul) | |
| Borntrager | Quinonas | ++ |
| Wagner | Alcaloides | - |
| Mayer | - | |
| Dragendorff | - | |
| Reineckato de Amonio | - |
Además, la presencia de compuestos fenólicos (taninos principalmente) revelaron su presencia a través de las reacciones de Gelatina/Sal y FeCl3 (taninos hidrolizables) y concuerdan con los resul tados de la misma porción de la planta de especies del mismo género como el extraído de la porción soluble acuosa del Schinus molle (Iannacone & Alvariño, 2010) y del aceite esencial extraídos de las hojas del Schinus polygamus (González et al., 2004).
No se fue detectada la presencia de alcaloides en ninguna de las pruebas pero ello no significa su ausencia, sólo que las pruebas de Wagner, Mayer, Draggendorff y Reineckato de amonio no lo pudieron revelar debido a la baja concentración en el extracto como en el S. molle (López et al., 2017)
Con respecto a la presencia de flavonoides, la prueba de Shinoda (+) y la reacción del AlCl3 (++) han revelado la presencia de flavonoides, sin embargo, las pruebas de Baljet y fluorescencia no han revelado la presencia de cumarinas y compuestos relacionados. Este resultado fue esperado debido a la amplia distribución de flavonoides (Taiz & Zeiger, 2010) en la naturaleza y la distribución restricta de cumarinas. La presencia de flavonoides en el extracto de hojas del S. weinmanifolia consonancia con otros estudios de especies relacionadas en las que también ya fueron descritos flavonoides encontrados en extracto metanólico de hojas del Schinus longifolius (Agudelo et al., 2013), además en hojas y frutos de la especie Schinus molle (López et al, 2017).
Por la gran variedad de especies presentes en el género, y de acuerdo a los datos no se han reportado la presencia de cumarinas, quinonas, sesquiterpenlactonas, en contrapartida se han detectado gran cantidad de derivados terpenoides, especialmente en el aceite esencial extraido de las hojas del S. molle, además del S. terebintifolius, S. polygamus y S. longifolius, además de compuestos con núcleo esteroidales (Gehrke, 2012)
Compuestos fenólicos totales
Se muestra los resultados obtenidos de la cuantificación de Compuestos Fenólicos Totales calculados a partir de la ecuación A=0.0950[Conc]+0.0114, arrojando el valor de 72.1± 2.06 mg GAE.g-1
Análisis similares en especies del mismo género como S. longifolius demostraron la presencia de 206 ± 15,1 mg Ac. Gálico.g-1 de extracto metanólico de las hojas (Agudelo et al., 2013) y 228 de Ac. Gálico.g-1 en el extracto etanólico de hojas del S. terebenthifolius obtenido por Soxleth (Costa et al., 2015). Por los diferentes solventes de extracción y técnicas de macerado, estos resultados son difíciles de comparar. Generalmente se observa mayor can tidad de compuestos polifenólicos en los extractos etanolicos (Tiwari et al., 2011). El resultado sugirió que de acuerdo a las pruebas cualitativas de taninos y flavonoides fueron concordantes entre si.
Flavonoides totales
La cuantificación de compuestos con núcleo que respondieron a los flavonoides arrojó por resultado (expresado en mg Quercetina.g-1 extracto) 40,7±6,40 en el Extracto crudo etanólico (SC) a partir de la ecuación A=0.00685[Conc]-0.00462. Otros estudios en hojas de especies relacionadas revelaron la presencia de flavonoides en el extracto de etanólico de hojas de S. longifolius con un valor de 1,11± 0,10 mg rutina.g-1 de extracto etanólico; comparando numéricamente se observó que el extracto crudo etanólico de la especie en estudio se mostró muy por encima del valor reportado por una especie del mismo género, pero por debajo de 69.67 ± 3.34 mg Quercetina.g-1 de extracto etanólico reportado por la especie S. terebinthifolius (Uliana et al., 2016).
Actividades biológicas
Prueba de actividad antioxidante
La cantidad de compuestos antioxidantes viene expresado como los mg de Ácido por gramo de extracto calculados a partir de una curva de calibración con patrones de referencia de concentración conocida (Quercetina USP) vs la absorbancia de las mismas (A=-0.00314[Conc]+0.4498), en donde mostró valor de 0,509±0,0224 mg Ácido Ascórbico.g-1 para el Extracto Crudo etanólico (SC).
Considerando la actividad expresada en % de Actividad Antioxidante tenemos que para SC fue 39,9% (calculado a partir de la ecuación A=-0,00134[Conc]+0.4184 con un IC50 de 0,154 mg.mL-1) comparando con el IC reportado de 19,4 % en Schinus terebethifolius (da Silva et al., 2017) es elevado pero menor que en los aceites esenciales extraídos del Schinus molle con un valor de 90 ± 1.23 %.(Salem et al., 2016), el cual fue considerado como especie estabilizadoras de radicales DPPH y por consiguiente su marcado efecto.
Con estos resultados, el S. weinmannifolia se comparan con el S. molle (Hosni et al., 2011) y el S. lentifolius (Gehrke, 2012), los cuales son las especies de mayor actividad antioxidante.
Prueba de actividad antimicrobiana
En función a la escala de actividad antimicrobiana se tiene los siguientes criterios: < 9 mm, inactivo; 9-12 mm, parcialmente activo; 13-18 mm, activo; >18 mm, muy activo (De Almeida et al., 2000). A la luz de los resultados, se han observado que por la técnica de difusión en disco, la actividad del extracto crudo etanólico (SC) (Tabla 2) ensayado sobre cepas de Escherichia coli, Salmonella typhymorium arrojaron como resultado que las mismas son parcialmente activas a concentraciones de 30 mg.mL-1, parcialmente activas contra Enteroccocus faecalis y Pseudomonas aeruginosa a una concentración de 20 mg.mL-1, así como parcialmente activo contra Candida albicans a una concentración de 25 mg.mL-1 e inactivo contra Staphylococcus epidermidis y Staphylococcus aureus.
El resultado de este ensayo demostró que los compuestos con posibles actividades antimicrobianas se encuentran en SC pero sólo a elevadas concentraciones. Estos resultados se contrastan con los reportados por extractos acuoso/etanólico de hojas de la especie Schinus Terebinthifolius, en donde mostró un elevado halo de inhibición sobre S. aureus (27,8 mm), además de E. coli (23,6 mm) y C. albicans (25,3 mm) (Martínez et al., 1996).
Tabla 2. Resultados de ensayo de Disco difusión en SC.
| Microorganismo | Halo de Inhibición (mm) 20 mg.mL-1 | Halo de Inhibición (mm) 25 mg.mL-1 | Halo de Inhibición (mm) 30 mg.mL-1 | Halo de Inhibición (mm) Control Positivo |
| Escherichia coli | 8 | 8 | 10 | 34 |
| Salmonella typhimurium 6 8 9 34 | 6 | 8 | 9 | 34 |
| Enterococcus faecalis | 9 | 10 | 11 | 44 |
| Pseudomonas aeruginosa | 8 | 8 | 10 | 32 |
| Staphylococcus epidermidis | 7 | 8 | 8 | 21 |
| Staphylococcus aureus | 7 | 8 | 8 | 21 |
| Candida albicans | 7 | 10 | 8 | 22 |
Actividades antimicrobianas también fueron observados en el aceite esencial del Schinus polygamus, dando resultados positivos contra las bacterias E.coli, K. pneumoniae, S. aviatum, S. aeruginosa (Erazo et al., 2006).
Una de las especies más estudiadas del género es el Schinus molle, que tanto en extracto de frutos, como en el extracto crudo de hojas y más aún en el aceite esencial han demostrado ser efectivos contra diferentes bacterias (Simionatto et al., 2011). Considerando además la edad gestacional de la planta, se ha reportado que, mientras más adulta es la planta, mayor es su actividad contra las mismas cepas objetos de estudio (Hosni et al., 2011).
Existen disidencias en cuanto a las actividades frente a los diversos microorganismos, los mismos, al igual que las divergencias en la actividad anti-oxidante podrían ser atribuidas a la metodología de extracción aplicada para el estudio, así como de la muestra extraída (aceites esenciales) o por la diferente composición de metabolitos activos de acuerdo a la localidad, ya que se sabe que diferentes partes de la planta varían su composición de metabolitos de acuerdo al ambiente en que se encuentran (Sepúlveda et al., 2003).
Actividad hemolítica
La propiedad hemolítica de moléculas ha sido el fundamento determinante en el desarrollo de diferentes potenciales terapéuticos; la cual se relaciona directamente con la lisis con otras actividades biológicas como la antitumoral, adyuvante y anti- inflamatoria, los que han tenido buenos resultados sobre las membranas celulares (Wang et al., 2007). En el extracto crudo etanólico analizado de la especie vegetal en estudio se ha mostrado un IC50 de 179 μg.mL-1 y una actividad del 55,9 % (Tabla 3) frente a un patrón de referencia de comprobada actividad hemolítica como el Dodecilsulfonato de sodio (SDS).
Conclusión
La especie fue identificada como Schinus weinmanniifolia Mart. ex Engl. Se obtuvo un rendimiento de extracción del 6,32 g.100 g-1 de extracto etanólico proveniente de las hojas de la especie vegetal en estudio, obtenido por la técnica de maceración exhaustiva.
El Perfil Fitoquímico reveló la presencia de flavonoides, taninos y compuestos esteroidales y la ausencia de los demás grupos de compuestos. Se cuantificaron la cantidad de fenoles totales 72.1 mg de Ac. Galico.g-1 de Extracto Crudo (SC) y la de flavonoides totales 40,7 mg de Quercetina.g-1.
El extracto bruto etanólico (SC) mostró que fue parcialmente activos contra cepas de E. coli, S. typhimurium, E. faecalis, P. aeruginosa, C. albicans en placa. La actividad antioxidante fue medida en porcentaje de inhibición dando como resultado SC fue 39,9%, para SH fue 22,9% y la actividad hemolítica en SC se observó que presentó un valor de IC50 de 179 µg.mL-1 y una actividad del 55,9 %, arrojando resultados prometedores para su uso en líneas celulares tumorales.












 uBio
uBio